¿Qué distingue a nuestra tierra de los demás planetas rocosos conocidos, dentro o fuera de nuestro sistema solar? ¿Los mares y océanos, que cubren buena parte del planeta? ¿Los continentes, con su gran diversidad de climas y geografía? ¿El cielo azul? ¿Los organismos que habitan todos estos ambientes? Sí, son todas características de nuestra tierra, que le proporcionan un lugar tal vez único entre los planetas conocidos. Pero hay una cosa más, que hace que nuestra tierra esté repleta de vida, que el cielo sea azul, y muchas cosas más: el oxígeno.
A diferencia de los demás planetas conocidos, nuestro planeta cuenta con una atmósfera rica en oxígeno (casi 21%, por volumen). Además, cuenta con miríadas de especies de organismos. ¿Coincidencia? Probablemente no. El oxígeno permitió la florescencia de la vida. Pero también ocurrió lo opuesto: la vida como la causa de la alta concentración de oxígeno en la atmósfera de la tierra. Veamos en esta entrega qué sabemos al respecto.
Antes del salto
Para estudiar la oxigenación de la atmósfera terrestre tenemos que volver la mirada atrás, hacia una fase de la historia de la tierra denominada el Arcaico, que – tal como vimos en la entrega de este blog del 14 junio 2018 (La tierra primordial) – terminó hacia 2500 millones de años, coincidiendo con la aparición del oxígeno (ver la línea de tiempo). La atmósfera en aquel entonces estaba caracterizada por la presencia de metano y – por lo menos de manera episódica – de una bruma de compuestos orgánicos [i]. Los continentes acababan de formarse: entre unos 2750 y 2600 millones de años antes del presente se dio la producción de masas continentales más importante de la historia del planeta [ii]. Los continentes eran completamente distintos en forma de los que conocemos ahora, pero eran grandes, rodeados por mares y océanos en los cuales se depositaban sedimentos erosionados de los continentes. En los mares y en charcas en los continentes ya había organismos vivientes: se trataba únicamente de organismos unicelulares, aun sin núcleo, la mayoría flotando en las aguas. Pero también había, ancladas en el fondo marino en aguas someras, colonias de organismos unicelulares denominadas estromatolitos. Estos organismos no producían oxígeno como los organismos actuales, sino metano y otros gases (ver la entrega del 12 agosto 2018, Los primeros organismos). El oxígeno era más bien un veneno para estos primeros organismos.
Durante el Arcaico, la temperatura en la superficie de la tierra era más elevada de la actual. Sin embargo, a finales del Arcaico y el inicio del eón sucesivo, el Proterozoico, esto cambió. Ocurrió una larga fase de inestabilidad climática, con importantes edades de hielo durante las cuales glaciares cubrían buena parte de los continentes y los océanos [iii]. A esta bajada de las temperaturas puede haber contribuido la aparición de nuevas especies de organismos, de lo que hablaremos más adelante.
Historia del oxígeno
La tierra no siempre ha tenido oxígeno en la atmósfera. Tal como vimos en la entrega del 14 junio 2018, nuestro planeta, recién formado, tenía una atmósfera consistente de otros gases, entre los que destacan el metano, el hidrógeno, y probablemente el dióxido de carbono (CO2). El oxígeno no estaba entre éstos, o de estar, su presencia era prácticamente nula. En lugar de las rocas rojizas, que se forman hoy en día por la oxidación del hierro, se formaron inicialmente rocas grisáceas en las cuales el hierro más bien había desaparecido, disuelto por procesos que ocurren con la ausencia de oxígeno [iv]. Durante la primera mitad de la existencia de la tierra, el oxígeno brillaba por su ausencia en la atmósfera (ver línea de tiempo). Esto cambió de manera drástica al final del Arcaico, cuando ocurrió algo que se denominó la Gran Oxidación, o, de manera un poco más dramática, la Revolución del Oxígeno [v].
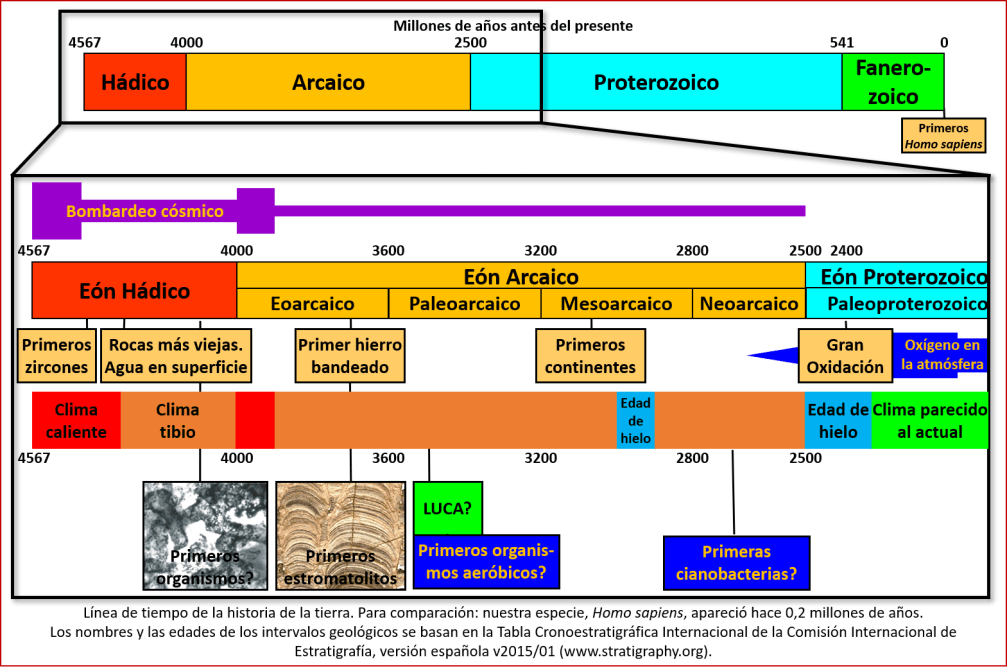
Este evento está datado con bastante exactitud: hasta hace 2450 millones de años, la relación de los isótopos de azufre (32S, 33S, 34S, 36S) mostraba una variabilidad importante, independiente de la que se esperaría con base a las masas de los distintos isótopos (causada por la actividad volcánica combinada con radiación ultravioleta [vi]); esto es típico de la presencia de metano en la atmósfera y una ausencia de oxígeno, aunque también puede tener otras causas [vii]. Hace 2320 millones de años está variabilidad había desaparecido, dando paso a la relación isotópica actual – lo que indica un importante aumento en la concentración de oxígeno en la atmósfera, y la desaparición del metano [viii]. En aquel tiempo empezó también a aparecer el metal cromo en los sedimentos marinos, proveniente de la oxidación de rocas en la superficie de los continentes [ix]. El evento fue gradual y con importantes fluctuaciones en la cantidad de oxígeno en la atmósfera: empezó hace 2426 millones de años, con la formación de depósitos de manganeso oxidado indicativos de la presencia de oxígeno (depósitos de manganeso más viejos no se consideran indicadores de oxígeno [x]), y puede haber durado hasta hace 2250 millones de años [xi].
El oxígeno todavía no alcanzó la concentración que tiene hoy en día (eso ocurrió después de la segunda fase de oxidación – ver abajo), pero, con una concentración de más de una quinta parte de la concentración actual [xii], hubo suficiente oxígeno para cambiar de manera dramática la historia de nuestro planeta.
Antes de la Gran Oxidación, a lo largo de la segunda mitad del Arcaico, hubo eventos locales y/o de duración limitada, durante los que aumentó la presencia de oxígeno en la atmósfera o en el agua, pero al parecer no de manera permanente. Las relaciones isotópicas del carbono en sedimentos marinos de antes de la Gran Oxidación, desde hace 2700 millones de años, apuntan a la presencia de organismos aeróbicos, o sea, que respiraban oxígeno [xiii]. Un enriquecimiento en los elementos molibdeno y renio, en arcillas marinas de hace 2640-2500 millones de años, indica la erosión oxidativa de rocas sulfídicas en el continente, y las relaciones isotópicas del molibdeno así como las del azufre son típicas de la presencia de oxígeno [xiv]. Óxidos de manganeso, formados en sedimentos marinos plataformales de hace 2500 millones de años, indican que los mares bordeando los continentes estaban bien oxigenados, por lo menos en ciertos lugares [xv]. También se formaron en aquel tiempo, producto de la acción de ciertos microbios, los primeros nitratos, que son óxidos (compuestos oxidados, o sea, con átomos de oxígeno) del nitrógeno [xvi]. En aguas someras en lo que hoy día es Australia hubo cierta cantidad de oxígeno hace 2660 millones de años, tal como lo indican las relaciones isotópicas del nitrógeno y el selenio [xvii] (pero la ausencia de molibdeno en la misma época sugiere más bien ausencia de oxígeno en la atmósfera [xviii]). Las relaciones isotópicas de azufre, en rocas de hace 2760 y 2920 millones de años, pudieran indicar la presencia de oxígeno en el aire [xix]. Más viejos, de hace 3000 millones de años, o sea 600 millones de años de la Gran Oxidación, son los indicios de la presencia de pequeñas cantidades de oxígeno en la atmósfera, dados por la distribución de los isótopos de cromo en rocas de Sudáfrica [xx]; y los isótopos de carbono y hierro sugieren la presencia de oxígeno en ciertos mares hace 3481 millones de años [xxi]. La presencia de cristales del mineral hematita (un óxido de hierro) en rocas que se formaron hace 3460 millones de años en un ambiente marino, también apunta a la presencia de oxígeno en el mar en aquel tiempo [xxii]. Es posible que en el Arcaico hubo oxígeno en el mar, aunque la atmósfera por lo general no contuviera este elemento [xxiii]. También es posible que hubo oxígeno en ciertos suelos, mientras que la atmósfera siguió desprovista de oxígeno [xxiv].
El oxígeno libre (o sea, en la forma del gas O2), necesario para estas oxidaciones tempranas, puede haber sido generado a partir del peróxido de hidrógeno (H2O2), que se forma bajo la influencia de radiación ultravioleta [xxv] (ver abajo).
Sin embargo, el oxígeno que puede haber entrado a la atmósfera durante estos eventos, probablemente desapareció rápidamente: el oxígeno es un elemento muy reactivo, que fácilmente se liga con elementos tales como el hierro y el azufre, que de esta manera actúan como aspiradores del oxígeno [xxvi].
Tampoco se debe pensar que, después de la Gran Oxidación, la concentración del oxígeno en la atmósfera se haya mantenido alta todo el tiempo. Estudios indican una reducción de esta concentración hace 2100 millones de años [xxvii] (cuando desapareció el sulfato, que es una forma oxidada del azufre [xxviii]), y otra hace 1880 millones de años (reflejada en cambios en la variación de las proporciones de los isótopos del cromo [xxix]), y es posible que se haya mantenido baja durante buena parte del Proterozoico [xxx].
Así que, a diferencia de lo que se opinaba inicialmente, la historia del oxígeno en la atmósfera y los océanos no es un simple aumento con dos saltos grandes, sino una alternancia de unas fases con más y otras con menos oxígeno [xxxi].
Oxígeno en el océano
El agua de los mares normalmente contiene cierta cantidad de oxígeno disuelto. La cantidad no es enorme – unos 8 a 10 miligramos de oxígeno por litro de agua, a una temperatura de 20°C – pero es suficiente para que puedan vivir en el agua una multitud de organismos que requieren de oxígeno para su respiración. Agua que no contiene oxígeno se denomina anóxica; en ella sólo pueden vivir organismos anaeróbicos [xxxii].
Probablemente, la concentración de oxígeno empezó a subir, aunque fuera moderadamente [xxxiii], en las aguas superficiales de los océanos, donde vivían los organismos que empezaron a producir oxígeno en forma libre [xxxiv] (ver abajo). Más tarde el oxígeno empezó a acumularse en la atmósfera también [xxxv]. La oxidación de las partes profundas de los océanos fue más lenta, y la concentración de oxígeno se mantuvo baja hasta finales del Proterozoico [xxxvi] (lo que quedó reflejado en una baja proporción de molibdeno, cuya presencia está relacionada a la de oxígeno [xxxvii]). De la oxigenación de los océanos después de la Gran Oxidación volveremos a hablar en la próxima entrega.
Origen del oxígeno
El oxígeno que actualmente se encuentra en la atmósfera y la superficie de la tierra, proviene del interior del planeta. Se ha determinado que, cerca de la base del manto terrestre (a una profundidad de unos 2800 km por debajo de la superficie), se encuentra una zona rica en óxidos e hidratos de hierro. En épocas de mucha actividad tectónica, tales como el final del Arcaico [xxxviii], el oxígeno puede haberse desplazado en grandes cantidades hacia arriba, llegando a la superficie terrestre mediante erupciones volcánicas. Esto pudiera explicar el fuerte aumento de oxígeno en la atmósfera durante la Gran Oxidación [xxxix]. Probablemente no sea una coincidencia que el inicio de la Gran Oxidación ocurriera poco tiempo después de una importante fase de actividad volcánica [xl]. Cabe destacar que el oxígeno llegó a la superficie no en forma libre (como O2), sino ligado a otros elementos en moléculas de distintos tipos, por ejemplo el dióxido de carbono.
Otra manera en que la actividad tectónica de finales del Arcaico puede haber causado la Gran Oxidación, es que al parecer cambió la composición de la corteza (la capa de rocas superficial de la tierra): la aparición de zircones, minerales ricos en sílice, indica que la litosfera tenía más sílice y menos hierro que antes. Menos hierro aflorando en la superficie implica menos oxidación del oxígeno, y por ende la posibilidad de acumularse el oxígeno en la atmósfera [xli].
La vida en la Gran Oxidación
De la aparición de la vida en la tierra y de los primeros organismos hemos hablado en las entregas anteriores: Los primeros organismos, Amanecer, y Amanecer con una nueva luz. Cuando ocurrió la Gran Oxidación, hace unos 2400 millones de años, la vida terrestre ya tenía más de mil millones de años existiendo. Durante este tiempo se había desarrollado bastante, pero siguió siendo sencilla: los organismos seguían siendo unicelulares, y las células todavía estaban sin núcleo: eran procariotas. Algunas especies vivían en colonias, formando construcciones globulares en aguas someras, los estromatolitos. Muchas otras especies vivían de forma individual en los mares y probablemente en ciertos lagos. En tierra todavía no había vida, lo que se debe a la incidencia de rayos ultravioletas (UV), que causan daños graves en el material genético [xlii] (al no haber oxígeno y por ende ozono (O3) en la atmósfera, no existía la barrera contra los rayos UV que tenemos ahora).
Entre los grupos de bacterias de aquel entonces estaban las cianobacterias, caracterizadas por la capacidad de producir oxígeno mediante el proceso de fotosíntesis, que es un sofisticado y poderoso sistema para la producción de energía a partir de la luz solar. De la fotosíntesis hablaremos a continuación. Las cianobacterias aparecieron mucho antes de la Gran Oxidación, hace por lo menos 2700 millones de años [xliii]. Los demás organismos vivientes obtenían su energía de otras fuentes, entre las cuales se encontraba el azufre. Para estos organismos, el oxígeno era una substancia tóxica.
La Gran Oxidación se dio cuando ocurrió una expansión global de cianobacterias que producían oxígeno libre (o sea, en la forma de O2), y de organismos eucariotas que lo respiraban [xliv]. De los eucariotas, que son organismos cuyas células contienen un núcleo y que requieren de oxígeno para su funcionamiento [xlv], hablaremos en la próxima entrega.
La primera proteína capaz de procesar el oxígeno apareció hace aproximadamente 2900 millones de años – bastante antes de la Gran Oxidación. Una reconstrucción del árbol genealógico de las proteínas encontradas en organismos actuales indicó que esta proteína estaba relacionada a una enzima, que se formó en el mismo tiempo, capaz de disociar el peróxido de hidrógeno en agua y oxígeno [xlvi].
Cabe resaltar que, para la gran mayoría de organismos que vivían al inicio de la Gran Oxidación, el oxígeno era un veneno, ya que este elemento crea radicales libres peligrosos y causa reacciones dañinas para las células [xlvii].
Fotosíntesis
La producción de oxígeno por organismos es el resultado del proceso de fotosíntesis. La fotosíntesis es la conversión de materia inorgánica a materia orgánica gracias a la energía que aporta la luz. En este proceso la energía lumínica se transforma en energía química estable, en la forma de – entre otras – moléculas de ATP (adenosín trifosfato). El ATP le proporciona al organismo la energía para la síntesis de compuestos orgánicos a partir del dióxido de carbono. Los organismos que tienen la capacidad de llevar a cabo la fotosíntesis son llamados fotoautótrofos; incluyen en la actualidad, en el medio acuático, las algas y una gran variedad de bacterias (entre las cuales las cianobacterias), y en el medio terrestre las plantas [xlviii].
Se diferencian dos tipos de procesos fotosintéticos: la fotosíntesis oxigénica y la fotosíntesis anoxigénica. La primera es la propia de las plantas superiores, las algas y las cianobacterias, donde el dador de electrones es el agua y, como consecuencia, se desprende oxígeno. Mientras que la segunda, hoy en día menos relevante, la realizan las bacterias purpúreas y verdes del azufre, en las que el dador de electrones es el sulfuro de hidrógeno (H2S), y consecuentemente, el elemento químico liberado no será oxígeno sino azufre [xlix]. En términos generales, el proceso de la fotosíntesis es bastante bien conocido, pero consiste en muchos pasos, algunos de los que sólo ahora están siendo entendidos [l]. Inclusive se ha descubierto que juegan un papel en la fotosíntesis algunos fenómenos de la física cuántica, tales como el entrelazamiento entre partículas [li].
La fotosíntesis, en la actualidad, es el método más utilizado por los organismos para obtener la energía necesaria para funcionar. Pero esto no siempre fue así. Los primeros organismos que habitaron la tierra, en el Arcaico o inclusiva a finales del Hádico (ver línea de tiempo), no tenían mecanismos para utilizar la luz del sol como fuente de energía, así que obtenían su energía de otras fuentes. En la entrada del 12 agosto 2018 de este blog (Los primeros organismos) ya se mencionaron las arqueas metanogénicas, que obtienen su energía al convertir CO2 en metano, y las que hacen lo mismo convirtiendo el CO2 en acetato y otros compuestos orgánicos [lii]. Otra fuente de energía era la oxidación de sulfuro, o sea la conversión de azufre reducido, por ejemplo sulfuro de hidrógeno (el gas que da a los huevos podridos su olor típico), en sulfatos. Fósiles de bacterias de hace 2520 millones de años, o sea del final de Arcaico, contienen una variedad de isótopos del azufre que hace suponer que estas bacterias obtenían su energía procesando sulfuros [liii]. Pero ningún mecanismo para obtener energía era tan eficiente como la fotosíntesis, de manera que, una vez aparecido ese mecanismo para aprovechar la luz solar, éste se impuso sobre los demás mecanismos.
El primer mecanismo de fotosíntesis en desarrollarse, fue el anoxigénico, que no liberaba oxígeno, sino azufre. Bajo la influencia de la energía de la luz (UV), se recombinan CO2, agua y azufre en el organismo, para formar compuestos orgánicos (acetato) y sulfato. Posteriormente, al darse la reacción en la dirección opuesta, se genera energía para que pueda funcionar el organismo [liv]. Este mecanismo puede haberse desarrollado al inicio del Arcaico, hace más de 3500 millones de años, tal vez hace unos 3800 millones de años, que es cuando aparecieron los primeros sedimentos arcillosos ricos en los restos de organismos [lv], en alguna especie bacteriana precursora de las bacterias actuales (aun desconocemos cuál [lvi]). Esto implica que la mayoría de las bacterias antiguas puede haber sido capaz de realizar fotosíntesis [lvii].

La fotosíntesis oxigénica apareció después, posiblemente precedida por una fase transicional en la que se oxidaba manganeso [lviii]. En el proceso de la fotosíntesis oxigénica se recombinan agua y CO2, como siempre bajo la influencia de luz UV, para formar compuestos orgánicos, liberando oxígeno. Valores isotópicos de cromo indican que hace 2480 millones de años, poco antes del inicio de la Gran Oxidación, hubo bacterias aeróbicas [lix]. Pero estudios moleculares sugieren que las moléculas responsables de la conversión de luz en energía pueden haberse desarrollado mucho antes, tal vez hace 3500 o 3600 millones de años [lx].
Para el estudio de la aparición de la fotosíntesis nos sirven, aparte de los datos isotópicos y las reconstrucciones a partir de organismos actuales, los biomarcadores. Tal como ya vimos en la entrega del 12 agosto 2018 (Los primeros organismos), los biomarcadores son compuestos orgánicos que indican la presencia de algún proceso biológico o, sea, la presencia de organismos [lxi]. Al hallar en rocas antiguas algún biomarcador, podemos concluir que existieron organismos vivos en la época que se formaron estas rocas. Los organismos mismos probablemente no dejaron restos fósiles, pero sí pudieron haber dejado rastros de su existencia en la forma de moléculas específicas. A veces es posible relacionar un biomarcador a algún proceso específico o algún grupo de organismos en particular. Entre los biomarcadores que se han encontrado en las rocas de finales del Arcaico y que, al menos en bacterias modernas, están relacionados al proceso de fotosíntesis, figuran ciertos esteranos, hopanos y triterpenoides [lxii] (pero surgieron dudas si estos biomarcadores hallados de verdad provienen de las rocas arcaicas, o si son una contaminación posterior [lxiii]). Asimismo se encontraron carotenoides de la misma edad, compuestos también relacionados a la fotosíntesis, en ciertas bacterias [lxiv]. Se ha determinado que los esteranos, para cuya producción se requiere oxígeno (por lo menos diez moléculas de O2 por molécula de esterano), pueden ser producidos por ciertas bacterias aun en una atmósfera con muy poco oxígeno, de manera que pudieron haberse formado los primeros esteranos ya antes de la Gran Oxidación [lxv].

Todo apunta a que la fotosíntesis oxigénica apareció una sola vez, y que esto ocurrió en una clase de cianobacterias denominado oxifotobacterias [lxvi]. Las cianobacterias (ver imágenes) son un grupo (filo) de las bacterias; antes se pensaba que eran algas, y por ende su antiguo nombre de algas verdeazuladas. La capacidad de realizar fotosíntesis pasó de las cianobacterias a una multitud de otros organismos cuando ciertas algas capturaron a cianobacterias y las incorporaron en las células suyas y de sus descendientes como orgánulos celulares llamados cloroplastos (ver imagen). Entre los descendientes de estas algas están las plantas actuales, que hoy en día son responsables de la generación de buena parte del oxígeno libre en la atmósfera [lxvii].

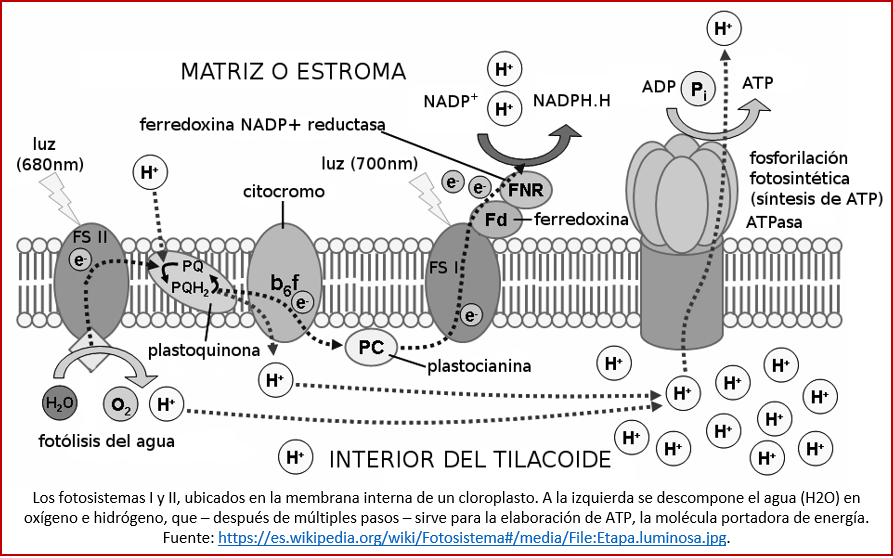
El proceso de la fotosíntesis requiere de múltiples pasos y compuestos. Dos conjuntos de proteínas son fundamentales: los fotosistemas I y II. Los dos provienen de un mismo conjunto ancestral, que según estudios moleculares apareció hace más de 3000 millones de años [lxviii]. Convierten la energía de la luz (específicamente, luz roja, con una longitud de onda de 680 y 700 nm, respectivamente) en energía útil para el organismo; para la fotosíntesis oxigénica, ambos complejos deben estar funcionando (ver imagen). En la actualidad, estos complejos están presentes en ciertos microorganismos fotosintéticos y en los cloroplastos de células vegetales [lxix]. (En cianobacterias de aguas más profundas, con poca luz, se ha identificado un fotosistema distinto, capaz de aprovechar la energía, más baja, de luz casi infrarroja [lxx].) Cada fotosistema consiste en una multitud de compuestos, entre los que es bien conocida la clorofila, que da a las hojas de las plantas su característico color verde. Otros compuestos, y otras reacciones que ocurren dentro de los fotosistemas, aun están siendo investigadas. Por ejemplo, sólo ahora se está entendiendo el funcionamiento de la tirosina, que juega un papel en la transmisión de los electronos que se liberan a descomponer el agua en oxígeno e hidrógeno [lxxi].
La oxidación despegó cuando microbios que practicaban la fotosíntesis fueron transportados – por corrientes, las mareas, o los vientos – a la tierra. Los que lograban sobrevivir a las altas dosis de radiación UV (hasta que no se acumulara suficiente ozono en la atmósfera, esta radiación mataba a la mayoría de los organismos que vivían en la zona fótica [lxxii]), encontraban allí un nicho ecológico vacío, repleto de alimentos en la forma de minerales varios, y lo llenaron rápidamente. De esta manera aumentó de manera importante la cantidad de oxígeno liberado en la atmósfera [lxxiii].
Fósforo y níquel
La Gran Oxidación iba de la mano de un aumento importante de la cantidad de los organismos vivientes, específicamente los aeróbicos – los que producen oxígeno. En parte, como ya vimos, este aumento de la biomasa se debió a la colonización de los continentes, donde se encontraron nuevos nichos ecológicos. Pero también puede haber jugado un papel importante, la disponibilidad de fósforo. El fósforo es un elemento clave para muchas moléculas en las células: aunque sólo se requiere en pequeñas cantidades, es un elemento fundamental, por ejemplo en los compuestos ATP y ADP, que – ya lo vimos – son los que acumulan energía para las células, y la proporcionan cuando es necesaria [lxxiv].
Nuestro planeta contiene poco fósforo, especialmente en cuanto a fósforo en compuestos reactivos se refiere. Posiblemente hubo enriquecimiento de fósforo reactivo al inicio del Arcaico, cuando los meteoritos que impactaron en la tierra durante el gran bombardeo cósmico pueden haber aportado mucho de este elemento [lxxv]. Se ha detectado un aumento en la cantidad de fósforo alrededor del límite entre el Arcaico y el Proterozoico, probablemente debido a actividad tectónica y la erosión de rocas con fósforo en los continentes [lxxvi]. Este fósforo fue transportado hacia el mar, y allí puede haber permitido que la cantidad de biomasa aumentara considerablemente, al haber suficiente fósforo. Inclusive, la cantidad de fósforo en el mar aumentó, después de la Gran Oxidación, hasta punto tal que un exceso de fósforo en los océanos causara la precipitación de depósitos ricos en fósforo [lxxvii].
Mientras que el fósforo es importante para los organismos aeróbicos, el níquel lo es para los organismos metanógenos, ya que forma parte de algunas enzimas clave en estos organismos. Los metanógenos, que producen metano, eran los responsables de mantener altas las concentraciones del metano en la atmósfera original de la tierra, antes de la Gran Oxidación, y en aquel entonces formaban buena parte de los organismos en nuestro planeta. El níquel era relativamente abundante en los océanos, cuando la tierra era joven, mientras que ahora es un elemento poco común. Su concentración subió hacia finales del Arcaico, probablemente como resultado de una fase de intensa actividad tectónica [lxxviii], para empezar a reducirse hace alrededor de 2700 millones de años, posiblemente como consecuencia de cambios en el subsuelo, donde se redujo la temperatura en el manto (la capa de rocas a una profundidad de entre unas decenas de kilómetros y casi 2900 km), de manera que las lavas, que se originan en aquella zona ya no contuvieran mucho níquel. La consecuente escasez de níquel en los océanos puede haber contribuido a la reducción en la cantidad de organismos metanógenos [lxxix].
Procesos inorgánicos
La acumulación de oxígeno en la atmósfera depende de muchos factores. En términos generales, para que pueda aumentar la concentración del oxígeno en la atmósfera, la tasa de generación de oxígeno libre debe exceder la tasa de eliminación del oxígeno de la atmósfera. Cuando empezó a generarse oxígeno libre, este fue secuestrado en primer lugar por las rocas y los suelos en la superficie de los continentes, y por el mar: la oxidación del hierro, azufre y otros elementos actuó como el primer sumidero del oxígeno. Sólo después de oxigenarse estos elementos, pudo empezar el oxígeno a acumularse en la atmósfera.
Un factor clave en el balance del oxígeno era, y es, el ciclo del carbono [lxxx]. El carbono tiende a reaccionar con oxígeno, reduciendo así la concentración del oxígeno en la atmósfera. Cuanto más sedimentos y rocas con carbono haya en la superficie terrestre, en la forma de roca calcárea, turba (precursor del carbón), etcétera, ocurre más captura del oxígeno. En épocas de mucha actividad tectónica que causa un soterramiento de estas rocas, éstas ya no pueden reaccionar con el oxígeno y la concentración de este elemento en la atmósfera puede aumentar. En efecto, se ha calculado que este efecto, conjuntamente a una mayor tasa de erosión en los continentes debido a la actividad tectónica, puede explicar buena parte de los dos principales aumentos de la proporción de oxígeno en la atmósfera: la Gran Oxidación al inicio del Proterozoico, y la segunda oxidación a finales de esa era [lxxxi].
Otros procesos que influyeron el balance del oxígeno en la atmósfera incluyen el escape de hidrógeno hacia el espacio (de manera que el oxígeno ya no podía reaccionar con este elemento, formando agua); la formación de ozono en los niveles altos de la atmósfera (que protege al oxígeno y a los organismos); la entrada, a través del volcanismo submarino, de gases reductores en la atmósfera (que contrarrestan la acción oxidativa del oxígeno); etcétera [lxxxii]. Se ha propuesto que un cambio de volcanismo predominantemente submarino a un volcanismo mayormente subaéreo (o sea, en los continentes), que produce menos gases reductores y que ocurrió a finales del Arcaico, haya contribuido a la Gran Oxidación [lxxxiii].
La acción combinada de todos estos factores hizo que la oxidación de la atmósfera fuera un proceso gradual y discontinuo, con fluctuaciones en la cantidad de oxígeno libre en el aire y el mar.
Era de hielo
La Gran Oxidación ocurrió al mismo tiempo que la primera gran época de hielo de la historia de la tierra: después de algunas edades de hielo de menor intensidad, se dio, hace 2300-2200 millones de años, un episodio durante el cual buena parte de la superficie terrestre estaba cubierta por una capa de hielo – lo que se denomina snowball Earth (“tierra bola de nieve”) [lxxxiv]. Esto probablemente no es coincidencia.
Inicialmente, cuando la fotosíntesis oxigénica aun no había desplazado la fotosíntesis anoxigénica, estos dos mecanismos, juntos, pueden haber apuntalado la presencia de metano en la atmósfera [lxxxv]. Otras bacterias, anaeróbicas, pueden haber producido grandes cantidades de metano también [lxxxvi]. Este gas causaba un importante efecto invernadero, o sea, calentaba la atmósfera. Sin embargo, cuando empezó a liberarse el oxígeno en la atmósfera, éste reaccionó con el metano de la atmósfera. Esta reacción resultaba en la formación de dióxido de carbono, cuyo efecto invernadero es mucho menor. Esto puede haber causado una importante bajada de las temperaturas, resultando en la formación de extensas capas de hielo [lxxxvii]. Las rocas sedimentarias típicamente relacionadas a estas capas de hielo, las diamictitas (ver la imagen en la portada de esta entrega), se encuentran en varias partes del mundo, lo que sugiere que la extensión del hielo durante la Gran Oxidación fue importante.
Los glaciares pueden haber ayudado en la oxigenación de la atmósfera y el mar, al propiciar primero la formación de peróxido de hidrógeno (H2O2) en su superficie bajo la acción de rayos UV, que después, en contacto con el agua del mar, se convierte en agua y oxígeno [lxxxviii]. El oxígeno liberado puede haber causado la deposición de las capas ricas en manganeso oxidado, a las que ya hicimos referencia [lxxxix].
Oxidaciones posteriores
Después de la Gran Oxidación, la atmósfera terrestre mantuvo una proporción más o menos importante de oxígeno, pero probablemente no más de unos 10% de la concentración actual; esto se debió probablemente a una limitada producción de oxígeno por los organismos vivientes, combinado con la presencia en la superficie continental de rocas sedimentarias ricas en material orgánico, cuya degradación consumía buena parte del oxígeno disponible en el aire [xc]. Sólo a finales del Proterozoico (lo que se llama el Neoproterozoico) se dio otro aumento del porcentaje de oxígeno, esta vez sí para alcanzar valores parecidos a los actuales – o sea, de unos 21%. Este aumento, denominado el Evento de Oxidación Neoproterozoico, ocurrió hace alrededor de 600 millones de años [xci], pero puede haber empezado bastante tiempo antes, ya que se pudo determinar (midiendo la composición de burbujas de gas en rocas salinas) que hace 815 millones de años la concentración de oxígeno en la atmósfera ya había alcanzado un valor de 10,9% [xcii]. Hace 580 millones de años estaban oxigenados también los océanos, y probablemente no es una coincidencia que al corto tiempo se desarrollaron allí los primeros animales [xciii]. El oxígeno había conquistado la tierra y, aunque en ciertos mares el oxígeno seguiría siendo escaso, e inclusive volvieran a acumularse depósitos de hierro hace 527 millones de años en la actual China, así como ocurrió antes de la Gran Oxidación [xciv], la concentración de oxígeno en la atmósfera no volvió a bajar más.
Volveremos a hablar de este evento en una entrega venidera. En este momento nos limitaremos a observar que, así como la Gran Oxidación puede haber sido causada por actividad tectónica, la oxidación neoproterozoica también puede haber estado relacionada a factores geológicos: al acumularse sedimentos ricos en carbono (relacionado a la actividad de organismos) y posteriormente soterrándose y recristalizándose, éstos pueden haber soltado grandes cantidades de oxígeno, suficiente para causar un fuerte aumento del oxígeno en la atmósfera [xcv]. Pero también pueden haber jugado un papel importante nuevos grupos de organismos que en aquel entonces empezaron a colonizar los continentes, que producían tanto oxígeno que hicieron posible esta segunda fase de oxidación [xcvi].
El gran envenenamiento
La Gran Oxidación, ese evento causado en gran medida por una innovación biológica – la fotosíntesis – nos muestra que la vida es una fuerza geológica importante, capaz de cambiar la historia de un planeta. Pero no ha sido una fuerza del todo benévola: la vida a veces llevó a si mismo al borde del abismo. En esta entrega vimos dos ejemplos de esto: en primer lugar, la fotosíntesis, y en segundo lugar, la tierra convertida en bola de nieve.
Es verdad que la aparición de la fotosíntesis permitió el desarrollo de la vida como en la actualidad la conocemos: dominada por organismos aeróbicos, que producen o respiran oxígeno. Pero ese producto liberado por la fotosíntesis, el oxígeno, causó una hecatombe en los ecosistemas del planeta coincidiendo con la Gran Oxidación: envenenó a los organismos que no tenían defensas contra el oxígeno, que eran la gran mayoría de formas de vida en la tierra. Tenemos suerte que algunos organismos desarrollaran defensas contra el oxígeno y lo supieron aprovechar para sus fines – porque, por el contrario, probablemente no estaríamos nosotros aquí, hablando de la Gran Oxidación [xcvii].
La bajada de la temperatura causada por la aparición del oxígeno y la concomitante reducción de los gases invernadero en la atmósfera, fue tal que nuestra tierra se cubrió en buena parte de capas de hielo – se volvió una bola de nieve. Una tal situación, que afortunadamente sólo ha ocurrido pocas veces en la historia de la tierra, es muy peligrosa, ya que es posible que un planeta envuelto en hielo cambie de clima y se convierta en un frigorífico, incapaz de sostener formas de vida más allá de unos microbios resistentes al frío. (Esto se debe al aumento de la reflectividad del planeta cuando está cubierto de hielo, de manera que el calor del sol se refleja hacia el espacio, en lugar de calentar el planeta.) De nuevo, estamos nosotros ahora aquí, lo que demuestra que la vida ha sobrevivido a esta fase de enfriamiento global, pero posiblemente nos hemos salvado por los pelos [xcviii].
Éstas son algunas lecciones que nos da la vida. No podemos confiarnos en que los ecosistemas en nuestro planeta sean capaces de mantener condiciones de vida óptimas. En los años setenta del siglo pasado, el biólogo británico James Lovelock lanzó una teoría revolucionaria, llamada la Hipótesis de Gaia, que considera que la misma vida mantiene ideales sus condiciones de vida, mediante sistemas de autorregulación [xcix]. Desafortunadamente no es del todo así, tal como nos muestran episodios como los arriba mencionados. Tal vez, propone el biólogo estadounidense Peter Ward, en lugar de hacer alusión a Gaia, la diosa griega de la tierra, se debería pensar en caracteres griegos más destructivos, y por ende llamó a su hipótesis que plantea que más bien tenemos suerte de haber sobrevivido a los eventos catastróficos causados por la vida, la Hipótesis de Medea – haciendo referencia a la madre que, en una tragedia griega, mata a sus hijos [c].
Conclusión
La oxidación de la superficie terrestre, la atmósfera y los océanos marcó un hito clave en la historia de nuestro planeta. Este acontecimiento, en el cual jugaron un papel fundamental los organismos aeróbicos, mediante el desarrollo de la fotosíntesis, impactó el desarrollo de la tierra, y de la vida en ella. Los organismos anaeróbicos, que dominaron la vida terrestre durante la primera mitad de la existencia del planeta, sufrieron un diezmado grave y fueron relegados a nichos remotos, alejados del oxígeno, tales como las profundidades de los océanos. Los organismos aeróbicos, por otro lado, sobrevivieron a esta Gran Oxidación y se convirtieron en los dueños del planeta.
Sin embargo, la Gran Oxidación no resultó en un ambiente rico en oxígeno tal como lo conocemos hoy en día. Durante millones de años se mantuvieron bajas las concentraciones de oxígeno, especialmente en los océanos, y fue sólo a finales del Proterozoico, la edad media de la tierra, que los niveles de oxígeno alcanzaran sus niveles actuales, y se pudiera dar una explosión en la cantidad de organismos y formas de vida. A esta edad media de nuestro planeta dedicaremos la próxima entrega.
Nota: la foto en el encabezado de esta entrega muestra una diamictita (roca formada por procesos sedimentarios relacionados a capas de hielo) de la formación Gowganda (del inicio del Proterozoico) en Ontario, Canadá. Crédito: Canadian Sedimentology Research Group. Fuente: https://wileyearthpages.wordpress.com/2013/11/27/earths-first-major-glacial-epochs/huronian-tillite.
[i] Zerkle, A.L., Claire, M.W., Domagal-Goldman, S.D., Farquhar, J. y Poulton, S.W., 2012. A bistable organic-rich atmosphere on the Neoarchaean Earth. Nature Geoscience, 5, 359-363. www.nature.com/articles/ngeo1425.
[ii] Lowe, D.R. y Tice, M.M., 2007. Tectonic controls on atmospheric, climatic, and biological evolution 3.5–2.4 Ga. Precambrian Research, 158, 177-197. www.sciencedirect.com/science/article/pii/S0301926807001222.
[iii] Bekker, A., Kaufman, A.J., Karhu, J.A., Beukes, N.J., Swart, Q.D., Coetzee, L.L. y Eriksson, K.A., 2001. Chemostratigraphy of the Paleoproterozoic Duitschland Formation, South Africa: Implications for coupled climate change and carbon cycling. American Journal of Science, 301 (3), 261-285. www.ajsonline.org/content/301/3/261.abstract.
[iv] Kump, L.R., 2008. The rise of atmospheric oxygen. Nature, 451, 277-278. www.nature.com/articles/nature06587.
[v] Ver: https://es.wikipedia.org/wiki/Gran_Oxidaci%C3%B3n.
[vi] Lin, M., Zhang, X., Li, M., Xu, Y., Zhang, Z., Tao, J., Su, B., Liu, L., Shen, Y. y Thiemens, M.H., 2018. Five-S-isotope evidence of two distinct mass-independent sulfur isotope effects and implications for the modern and Archean atmospheres. Proceedings of the National Academy of Sciences, 115 (34), 8541-8546. www.pnas.org/content/pnas/115/34/8541.full.pdf.
[vii] Watanabe, Y., Farquhar, J. y Ohmoto, H., 2009. Anomalous fractionations of sulfur isotopes during thermochemical sulfate reduction. Science, 324 (5925), 370-373. http://science.sciencemag.org/content/324/5925/370.
[viii] Farquhar, J., Bao, H. y Thiemens, M., 2000. Atmospheric influence of Earth’s earliest sulfur cycle. Science, 289 (5480), 756-758. http://science.sciencemag.org/content/289/5480/756. Bekker, A., Holland, H.D., Wang, P.-L., Rumble III, D., Stein, H.J., Hannah, J.L., Coetzee, L.L. y Beukes, N.J., 2004. Dating the rise of atmospheric oxygen. Nature, 427, 117-120. www.nature.com/articles/nature02260.
[ix] Konhauser, K.O. y otros, 2011. Aerobic bacterial pyrite oxidation and acid rock drainage during the Great Oxidation Event. Nature, 478, 369-373. www.nature.com/articles/nature10511.
[x] Johnson, J.E., Webb, S.M., Thomas, K., Ono, S., Kirschvink, J.L. y Fischer, W.W., 2013. Manganese-oxidizing photosynthesis before the rise of cyanobacteria. Proceedings of the National Academy of Sciences, 110 (28), 11238-11243. www.pnas.org/content/110/28/11238.
[xi] Gumsley, A.P., Chamberlain, K.R., Bleeker, W., Söderlund, U., de Kock M.O., Larsson, E.R. y Bekker, A., 2017. Timing and tempo of the Great Oxidation Event. Proceedings of the National Academy of Sciences, 114 (8), 1811-1816. www.pnas.org/content/114/8/1811.
[xii] Blättler, C.L. y otros, 2018. Two-billion-year-old evaporites capture Earth’s great oxidation. Science, 360 (6386), 320-323. http://science.sciencemag.org/content/360/6386/320.
[xiii] Eigenbrode, J.L. y Freeman, K.H., 2006. Late Archean rise of aerobic microbial ecosystems. Proceedings of the National Academy of Sciences, 103 (43), 15759-15764. www.pnas.org/content/103/43/15759.
[xiv] Anbar, A.D. y otros, 2007. A whiff of oxygen before the Great Oxidation Event? Science, 317 (5846), 1903-1906. http://science.sciencemag.org/content/317/5846/1903. Kaufman, A.J. y otros, 2007. Late Archean Biospheric Oxygenation and Atmospheric Evolution. Science, 317 (5846), 1900-1903. http://science.sciencemag.org/content/317/5846/1900. Wille, M., Kramers, J.D., Nägler, T.F., Beukes, N.J., Schröder, S., Meisel, Th., Lacassie, J.P. y Voegelin, A.R., 2007. Evidence for a gradual rise of oxygen between 2.6 and 2.5 Ga from Mo isotopes and Re-PGE signatures in shales. Geochimica et Cosmochimica Acta, 71 (10), 2417-2435. www.sciencedirect.com/science/article/pii/S0016703707001160.
[xv] Ostrander, C.M., Nielsen, S.G., Owens, J.D., Kendall, B., Gordon, G.W., Romaniello, S.J. y Anbar, A.D., 2019. Fully oxygenated water columns over continental shelves before the Great Oxidation Event. Nature Geoscience, 12, 186-191. www.nature.com/articles/s41561-019-0309-7.
[xvi] Garvin, J., Buick, R., Anbar, A.D., Arnold, G.L. y Kaufman, A.J., 2009. Isotopic evidence for an aerobic nitrogen cycle in the latest Archean. Science, 323 (5917), 1045-1048. http://science.sciencemag.org/content/323/5917/1045.
[xvii] Koehler, M.C., Buick, R., Kipp, M.A., Stüeken, E.E. y Zaloumis, J., 2018. Transient surface ocean oxygenation recorded in the ∼2.66-Ga Jeerinah Formation, Australia. Proceedings of the National Academy of Sciences, 115 (30), 7711-7716. www.pnas.org/content/115/30/7711.
[xviii] Scott, C.T., Bekker, A., Reinhard, C.T., Schnetger, B., Krapež, B., Rumble III, D. y Lyons, T.W., 2011. Late Archean euxinic conditions before the rise of atmospheric oxygen. Geology, 39 (2), 119-122. https://pubs.geoscienceworld.org/gsa/geology/article-abstract/39/2/119/130482/late-archean-euxinic-conditions-before-the-rise-of.
[xix] Ohmoto, H., Watanabe, Y., Ikemi, H., Poulson, S.R. y Taylor, B.E., 2006. Sulphur isotope evidence for an oxic Archaean atmosphere. Nature, 442, 908-911. www.nature.com/articles/nature05044.
[xx] Crowe, S.A., Døssing, L.N., Beukes, N.J., Bau, M., Kruger, S.J., Frei, R. y Canfield, D.E., 2013. Atmospheric oxygenation three billion years ago. Nature, 501, 535-538. www.nature.com/articles/nature12426#ref2.
[xxi] Van Zuilen, M.A., Philippot, P., Thomazo, C. Y Luais, B., 2010. Photosynthesis and iron‐oxide formation in a 3.5 billion‐year‐old anoxic ocean. NGF Abstracts & Proceedings, 2010 (1), 205.
[xxii] Hoashi, M., Bevacqua, D.C., Otake, T., Watanabe, Y., Hickman, A.H., Utsunomiya, S. y Ohmoto, H., 2009. Primary haematite formation in an oxygenated sea 3.46 billion years ago. Nature Geoscience, 2, 301-306. www.nature.com/articles/ngeo465.
[xxiii] Eickmann, B., Hofmann, A., Wille, M., Bui, T.H., Wing, B.A. y Schoenberg, R., 2018. Isotopic evidence for oxygenated Mesoarchaean shallow oceans. Nature Geoscience, 11, 133-138. www.nature.com/articles/s41561-017-0036-x.
[xxiv] Lalonde, S.V. y Konhauser, K.O., 2015. Benthic perspective on Earth’s oldest evidence for oxygenic photosynthesis. Proceedings of the National Academy of Sciences, 112 (4), 995-1000. www.pnas.org/content/pnas/112/4/995.full.pdf.
[xxv] Liang, M.-C., Hartman, H., Kopp, R.E., Kirschvink, J.L. Yung, Y.L., 2006. Production of hydrogen peroxide in the atmosphere of a Snowball Earth and the origin of oxygenic photosynthesis. Proceedings of the National Academy of Sciences, 103 (50), 18896-18899. www.pnas.org/content/103/50/18896.
[xxvi] Lee, C.-T.A., Yeung, L.Y., McKenzie, N.R., Yokoyama, Y., Ozaki, K. y Lenardic, A., 2016. Two-step rise of atmospheric oxygen linked to the growth of continents. Nature Geoscience, 9, 417-424. www.nature.com/articles/ngeo2707.
[xxvii] Canfield, D.E. y otros, 2013. Oxygen dynamics in the aftermath of the Great Oxidation of Earth’s atmosphere. Proceedings of the National Academy of Sciences, 110 (42), 16736-16741. www.pnas.org/content/110/42/16736.
[xxviii] Planavsky, N.J., Bekker, A., Hofmann, A., Owens, J.D. y Lyons, T.W., 2012. Sulfur record of rising and falling marine oxygen and sulfate levels during the Lomagundi event. Proceedings of the National Academy of Sciences, 109 (45), 18300-18305. www.pnas.org/content/109/45/18300.
[xxix] Frei, R., Gaucher, C., Poulton, S.W. y Canfield, D.E., 2009. Fluctuations in Precambrian atmospheric oxygenation recorded by chromium isotopes. Nature, 461, 250-253. www.nature.com/articles/nature08266.
[xxx] Lyons, T.W., Reinhard, C.T. y Planavsky, N.J., 2014. The rise of oxygen in Earth’s early ocean and atmosphere. Nature, 506, 307-315. www.nature.com/articles/nature13068.
[xxxi] Holland, H.D., 2006. The oxygenation of the atmosphere and oceans. Philosophical Transactions of the Royal Society B, 361, 903-915. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2006.1838.
[xxxii] Ver: https://es.wikipedia.org/wiki/Aguas_an%C3%B3xicas; www.fondriest.com/environmental-measurements/parameters/water-quality/dissolved-oxygen.
[xxxiii] Kipp, M.A., Stüeken, E.E., Bekker, A. y Buick, R., 2017. Selenium isotopes record extensive marine suboxia during the Great Oxidation Event. Proceedings of the National Academy of Sciences, 114 (5), 875-880. www.pnas.org/content/pnas/114/5/875.full.pdf.
[xxxiv] Zerkle y otros, 2012. Ver nota 1.
[xxxv] Guo, Q. y otros, 2009. Reconstructing Earth’s surface oxidation across the Archean-Proterozoic transition. Geology, 37 (5), 399-402. https://pubs.geoscienceworld.org/gsa/geology/article-abstract/37/5/399/29894.
[xxxvi] Canfield, D.E., Poulton, S.W. y Narbonne, G.M., 2007. Late-Neoproterozoic deep-ocean oxygenation and the rise of animal life. Science, 315 (5808), 92-95. http://science.sciencemag.org/content/sci/315/5808/92.full.pdf.
[xxxvii] Scott, C., Lyons, T.W., Bekker, A., Shen, Y., Poulton, S.W., Chu, X. y Anbar, A.D., 2008. Tracing the stepwise oxygenation of the Proterozoic ocean. Nature, 452, 456-459. www.nature.com/articles/nature06811.
[xxxviii] Keller, C.B. y Schoene, B., 2012. Statistical geochemistry reveals disruption in secular lithospheric evolution about 2.5Gyr ago. Nature, 485, 490-493. www.nature.com/articles/nature11024.
[xxxix] Mao, H.-K. y otros, 2017. When water meets iron at Earth’s core–mantle boundary. National Science Review, 4 (6), 870–878. https://academic.oup.com/nsr/article/4/6/870/4107791.
[xl] Gumsley y otros, 2017. Ver nota 17.
[xli] Lee y otros, 2016. Ver nota 26.
[xlii] Avila-Alonso, D., Baetens, J.M., Cardenas, R. y De Baets, B., 2017. Assessing the effects of ultraviolet radiation on the photosynthetic potential in Archean marine environments. International Journal of Astrobiology, 16 (3), 271-279. www.cambridge.org/core/journals/international-journal-of-astrobiology/article/assessing-the-effects-of-ultraviolet-radiation-on-the-photosynthetic-potential-in-archean-marine-environments/0E22FC42F2152C2C9672064327E46CC7.
[xliii] Cavalier-Smith, T., 2006. Cell evolution and Earth history: stasis and revolution. Philosophical Transactions of the Royal Society B, 361, 969-1006. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2006.1842.
[xliv] Guo y otros, 2009. Ver nota 35.
[xlv] Ver: https://es.wikipedia.org/wiki/C%C3%A9lula_eucariota.
[xlvi] Kim, K.M., Qin, T., Jiang, Y.-Y., Chen, L.-L., Xiong, M., Caetano-Anollés, D., Zhang, H.-Y. y G. Caetano-Anollés, 2012. Protein domain structure uncovers the origin of aerobic metabolism and the rise of planetary oxygen. Structure, 20 (1), 67-76. www.sciencedirect.com/science/article/pii/S0969212611004163.
[xlvii] Imlay, J.A., 2002. How oxygen damages microbes: Oxygen tolerance and obligate anaerobiosis. Advances in Microbial Physiology, 46, 111-153. www.sciencedirect.com/science/article/abs/pii/S0065291102460031. Ver también: https://en.wikipedia.org/wiki/Oxygen_toxicity.
[xlviii] Ver: https://es.wikipedia.org/wiki/Fotos%C3%ADntesis.
[xlix] Ver: https://es.wikipedia.org/wiki/Fotos%C3%ADntesis.
[l] Chandler, D.E., Strümpfer, J., Sener, M., Scheuring, S. y Schulten, K., 2014. Light Harvesting by Lamellar Chromatophores in Rhodospirillum photometricum. Biophysical Journal, 106, 2503-2510. www.cell.com/biophysj/abstract/S0006-3495(14)00447-0. Niedringhaus, A. y otros, 2018. Primary processes in the bacterial reaction center probed by two-dimensional electronic spectroscopy. Proceedings of the National Academy of Sciences, 115 (14), 3563-3568. www.pnas.org/content/115/14/3563. Selim, K.A., Haase, F., Hartmann, M.D., Hagemann, M. y Forchhammer, K., 2018. PII-like signaling protein SbtB links cAMP sensing with cyanobacterial inorganic carbon response. Proceedings of the National Academy of Sciences, 115 (21), E4861-E4869. www.pnas.org/content/115/21/E4861.short.
[li] Sarovar, M, Ishizaki, A., Fleming, G.R. y Whaley, K.B., 2010. Quantum entanglement in photosynthetic light-harvesting complexes. Nature Physics, 6, 462-467. www.nature.com/articles/nphys1652.
[lii] Sleep, N.H. y Bird, D.K., 2008. Evolutionary ecology during the rise of dioxygen in the Earth’s atmosphere. Philosophical Transactions of the Royal Society B, 363, 2651-2664. https://royalsocietypublishing.org/doi/pdf/10.1098/rstb.2008.0018.
[liii] Czaja, A.D., Beukes, N.J. y Osterhout, J.T., 2016. Sulfur-oxidizing bacteria prior to the Great Oxidation Event from the 2.52 Ga Gamohaan Formation of South Africa. Geology, 44 (12), 983-986. http://geology.gsapubs.org/content/44/12/983.full.pdf.
[liv] Sleep y Bird, 2008. Ver nota 52.
[lv] Sleep, N.H. y Bird, D.K., 2007. Niches of the pre‐photosynthetic biosphere and geologic preservation of Earth’s earliest ecology. Geobiology, 5 (2), 101-117. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1472-4669.2007.00105.x.
[lvi] Shih, P.M., Ward, L.M. Fischer, W.W., 2017. Evolution of the 3-hydroxypropionate bicycle and recent transfer of anoxygenic photosynthesis into the Chloroflexi. Proceedings of the National Academy of Sciences, 114 (40), 10749-10754. www.pnas.org/content/114/40/10749.
[lvii] Battistuzzi, F.U., Feijao, A. y Hedges, S.B., 2004. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land. BMC Evolutionary Biology, 4, 44. https://bmcevolbiol.biomedcentral.com/track/pdf/10.1186/1471-2148-4-44. Cardona, T., 2016. Origin of bacteriochlorophyll a and the early diversification of photosynthesis. PLoS ONE, 11 (3), e0151250. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0151250.
[lviii] Johnson y otros, 2013. Ver nota 10.
[lix] Konhauser y otros, 2011. Ver nota 9.
[lx] Cardona, T., 2018. Early Archean origin of heterodimeric Photosystem I. Heliyon, 4 (3), e00548. www.sciencedirect.com/science/article/pii/S2405844017336290. Cardona, T., Sánchez-Baracaldo, P. y Rutherford, A.W., 2018. Early Archean origin of Photosystem II. Geobiology, 2018, 1-24. https://onlinelibrary.wiley.com/doi/epdf/10.1111/gbi.12322.
[lxi] Ver: https://en.wikipedia.org/wiki/Biomarker.
[lxii] Summons, R.E., Bradley, A.S., Jahnke, L.L. y Waldbauer, J.R., 2006. Steroids, triterpenoids and molecular oxygen. Philosophical Transactions of the Royal Society B, 361, 951-968. http://rstb.royalsocietypublishing.org/content/361/1470/951. Fischer, W.W., 2008. Life before the rise of oxygen. Nature, 455, 1051-1052. www.nature.com/articles/4551051a.
[lxiii] French, K.L. y otros, 2015. Reappraisal of hydrocarbon biomarkers in Archean rocks. Proceedings of the National Academy of Sciences, 112 (19), 5915-5920. www.pnas.org/content/pnas/112/19/5915.full.pdf.
[lxiv] Cavalier-Smith, T., Brasier, M. y Embley, T.M., 2006. Introduction: how and when did microbes change the world? Philosophical Transactions of the Royal Society B, 361, 845-850. http://rstb.royalsocietypublishing.org/content/361/1470/845.
[lxv] Waldbauer, J.R., Newman, D.K. y Summons, R.E., 2011. Microaerobic steroid biosynthesis and the molecular fossil record of Archean life. Proceedings of the National Academy of Sciences, 108 (33), 13409-13414. www.pnas.org/content/pnas/108/33/13409.full.pdf.
[lxvi] Soo, R.M., Hemp, J., Parks, D.H., Fischer, W.W. y Hugenholtz, P., 2017. On the origins of oxygenic photosynthesis and aerobic respiration in Cyanobacteria. Science, 355 (6332), 1436-1440. http://science.sciencemag.org/content/sci/355/6332/1436.full.pdf.
[lxvii] Ver: https://es.wikipedia.org/wiki/Cyanobacteria.
[lxviii] Orf, G.S., Gisriel, C. y Redding, K.E., 2018. Evolution of photosynthetic reaction centers: insights from the structure of the heliobacterial reaction center. Photosynthesis Research, 138, 11. https://rd.springer.com/article/10.1007%2Fs11120-018-0503-2.
[lxix] Ver: https://es.wikipedia.org/wiki/Fotosistema.
[lxx] Nürnberg, D.J. y otros, 2018. Photochemistry beyond the red limit in chlorophyll f–containing photosystems. Science, 360 (6394), 1210-1213. http://science.sciencemag.org/content/360/6394/1210. Swingley, W.D. y otros, 2008. Niche adaptation and genome expansion in the chlorophyll d-producing cyanobacterium Acaryochloris marina. Proceedings of the National Academy of Sciences, 105 (6), 2005-2010. www.pnas.org/content/pnas/105/6/2005.full.pdf.
[lxxi] Guo, Z., He, J. y Barry, B.A., 2018. Calcium, conformational selection, and redox-active tyrosine YZ in the photosynthetic oxygen-evolving cluster. Proceedings of the National Academy of Sciences, 115 (22), 5658-5663. www.pnas.org/content/pnas/115/22/5658.full.pdf.
[lxxii] Mloszewska, A.M., Cole, D.B., Planavsky, N.J., Kappler, A., Whitford, D.S., Owttrim, G.W. y Konhauser, K.O., 2018. UV radiation limited the expansion of cyanobacteria in early marine photic environments. Nature Communications, 9, 3088. www.nature.com/articles/s41467-018-05520-x.
[lxxiii] Battistuzzi y otros, 2004. Ver nota 57.
[lxxiv] Ver: https://en.wikipedia.org/wiki/Adenosine_diphosphate.
[lxxv] Pasek, M.A., Harnmeijer, J.P., Buick, R., Gull, M. y Atlas, Z., 2013. Evidence for reactive reduced phosphorus species in the early Archean ocean. Proceedings of the National Academy of Sciences, 110 (25), 10089-10094. www.pnas.org/content/pnas/110/25/10089.full.pdf. Bryant, D.E. y otros, 2013. Hydrothermal modification of the Sikhote-Alin iron meteorite under low pH geothermal environments. A plausibly prebiotic route to activated phosphorus on the early Earth. Geochimica et Cosmochimica Acta, 109, 90-112. www.sciencedirect.com/science/article/pii/S0016703713000161.
[lxxvi] Papineau, D., 2010. Global biogeochemical changes at both ends of the Proterozoic: Insights from phosphorites. Astrobiology, 10, 165-181. www.liebertpub.com/doi/10.1089/ast.2009.0360. Greber, N.D., Dauphas, N., Bekker, A., Ptáček, M.P., Bindeman, I.N. y Hofmann, A., 2017. Titanium isotopic evidence for felsic crust and plate tectonics 3.5 billion years ago. Science, 357 (6357), 1271-1274. http://science.sciencemag.org/content/357/6357/1271.
[lxxvii] Lepland, A. y otros, 2014. Potential influence of sulphur bacteria on Palaeoproterozoic phosphogenesis. Nature Geoscience, 7, 20-24. www.nature.com/articles/ngeo2005.
[lxxviii] Greber y otros, 2017. Ver nota 76.
[lxxix] Konhauser, K.O. y otros, 2009. Oceanic nickel depletion and a methanogen famine before the Great Oxidation Event. Nature, 458, 750-753. www.nature.com/articles/nature07858.
[lxxx] Hayes, J.M. y Waldbauer, J.R., 2006. The carbon cycle and associated redox processes through time. Philosophical Transactions of the Royal Society B, 361, 931-950. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2006.1840.
[lxxxi] Husson, J.M. y Peters, S.E., 2017. Atmospheric oxygenation driven by unsteady growth of the continental sedimentary reservoir. Earth and Planetary Science Letters, 460, 68-75. www.sciencedirect.com/science/article/pii/S0012821X16307129.
[lxxxii] Claire, M.W., Catling, D.C. y Zahnle, K.J., 2006. Biogeochemical modelling of the rise in atmospheric oxygen. Geobiology, 4 (4), 239-269. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1472-4669.2006.00084.x. Sleep y Bird, 2008. Ver nota 52.
[lxxxiii] Kump, L.R. y Barley, M.E., 2007. Increased subaerial volcanism and the rise of atmospheric oxygen 2.5 billion years ago. Nature, 448, 1033-1036. www.nature.com/articles/nature06058.
[lxxxiv] Kopp, R.E., Kirschvink, J.L., Hilburn, I.A. y Nash, C.Z., 2005. The Paleoproterozoic snowball Earth: A climate disaster triggered by the evolution of oxygenic photosynthesis. Proceedings of the National Academy of Sciences, 102 (32), 11131-11136. https://www.jstor.org/stable/3376232.
[lxxxv] Ozaki, K., Tajika, E., Hong, P.K., Nakagawa, Y. y Reinhard, C.T., 2017. Effects of primitive photosynthesis on Earth’s early climate system. Nature Geoscience, 11, 55-59. www.nature.com/articles/s41561-017-0031-2.
[lxxxvi] Kasting, J.F. y Siefert, J.L., 2002. Life and the evolution of Earth’s atmosphere. Science, 296, 1066-1068. www.sciencemag.org/content/296/5570/1066.short.
[lxxxvii] Kopp y otros, 2005. Ver nota 83. Guo y otros, 2009. Ver nota 35.
[lxxxviii] Kirschvink, J.L. y Kopp, R.E., 2008. Palaeoproterozoic ice houses and the evolution of oxygen-mediating enzymes: the case for a late origin of photosystem II. Philosophical Transactions of the Royal Society B, 363, 2755-2765. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2008.0024.
[lxxxix] Kirschvink, J.L., Gaidos, E.J., Bertani, L.E., Beukes, N.J., Gutzmer, J., Maepa, L.N. y Steinberger, R.E., 2000. Paleoproterozoic snowball Earth: Extreme climatic and geochemical global change and its biological consequences. Proceedings of the National Academy of Sciences, 97 (4), 1400-1405. www.pnas.org/content/97/4/1400.
[xc] Daines, S.J., Mills, B.J.W. y Lenton, T.M., 2017. Atmospheric oxygen regulation at low Proterozoic levels by incomplete oxidative weathering of sedimentary organic carbon. Nature Communications, 8, 14379. www.nature.com/articles/ncomms14379.
[xci] Fike, D.A., Grotzinger, J.P., Pratt, L.M. y Summons, R.E., 2006. Oxidation of the Ediacaran ocean. Nature, 444, 744-747. www.nature.com/articles/nature05345.
[xcii] Blamey, N.J.F., Brand, U., Parnell, J., Spear, N., Lécuyer, C., Benison, K., Meng, F. y and Ni, P., 2016. Paradigm shift in determining Neoproterozoic atmospheric oxygen. Geology, 44 (8), 651-654. http://geology.gsapubs.org/content/44/8/651.full.pdf.
[xciii] Canfield y otros, 2007. Ver nota 36.
[xciv] Li, Z.-Q. y otros, 2018. Earth’s youngest banded iron formation implies ferruginous conditions in the Early Cambrian ocean. Scientific Reports, 8, 9970. www.nature.com/articles/s41598-018-28187-2.pdf.
[xcv] Lee y otros, 2016. Ver nota 26.
[xcvi] Daines y otros, 2017. Ver nota 90.
[xcvii] Ward, P., 2009. The Medea Hypothesis. Is Life on Earth Ultimately Self-Destructive? Princeton University Press. Pág. 75.
[xcviii] Ward, 2009. Ver nota 97. Pág. 75-76.
[xcix] Lovelock, J., 1979. Gaia. A new look at life on Earth. Oxford University Press. Lovelock, J., 1988. The ages of Gaia. A biography of our living Earth. Norton / Oxford University Press. Ver también: https://es.wikipedia.org/wiki/Hip%C3%B3tesis_Gaia.
[c] Ward, 2009. Ver nota 97. Ver también: https://en.wikipedia.org/wiki/Medea_hypothesis.

2 comentarios en “Los albores de la vida (5): La Gran Oxidación”