El Proterozoico, ya lo vimos en la entrega anterior, fue la Edad Media de la tierra: cuando empezó, hace 2500 millones de años, estaban apareciendo los primeros organismos eucariontes unicelulares y multicelulares, predecesores de – entre otros – los animales y las plantas, y fue sólo después de un intervalo larguísimo, de más de mil millones de años, que se dio el siguiente paso grande en el desarrollo de la vida en la tierra. Ya hemos hablado del inicio del Proterozoico; ahora nos corresponde considerar su final, que fue bastante espectacular: no sólo aparecieron nuevos organismos, sino también se convirtió nuestro planeta – afortunadamente por tiempo limitado – en una bola de nieve, y se alcanzó prácticamente la cantidad actual de oxígeno en la atmósfera.
Oxígeno
Tal como vimos en la entrega anterior, y también se puede apreciar en la línea de tiempo (ver la imagen), la atmósfera terrestre sí tuvo oxígeno durante el Proterozoico, pero en cantidades mucho más bajas que las actuales. Sólo hacia finales del Proterozoico, la proporción del oxígeno en la atmósfera alcanzó valores parecidos a los actuales. Se calculó a partir de isótopos de azufre que, desde hace 1180 millones de años la proporción de oxígeno empezó a aumentar [1], y que hace 1050 millones de años, esta proporción estaba alcanzando alrededor de una décima parte de la proporción actual (de 21% por volumen) [2]. Además, se pudo determinar, a partir de burbujas de aire atrapados en sal mineral que se formó hace 815 millones de años, que en aquel entonces el porcentaje de oxígeno ya había aumentado a 10,9% (la mitad del valor actual) [3]. Según otros autores, el porcentaje de oxígeno en la atmósfera alcanzó a finales del Proterozoico una cuarta parte del valor actual, gracias a una fase de actividad tectónica [4].
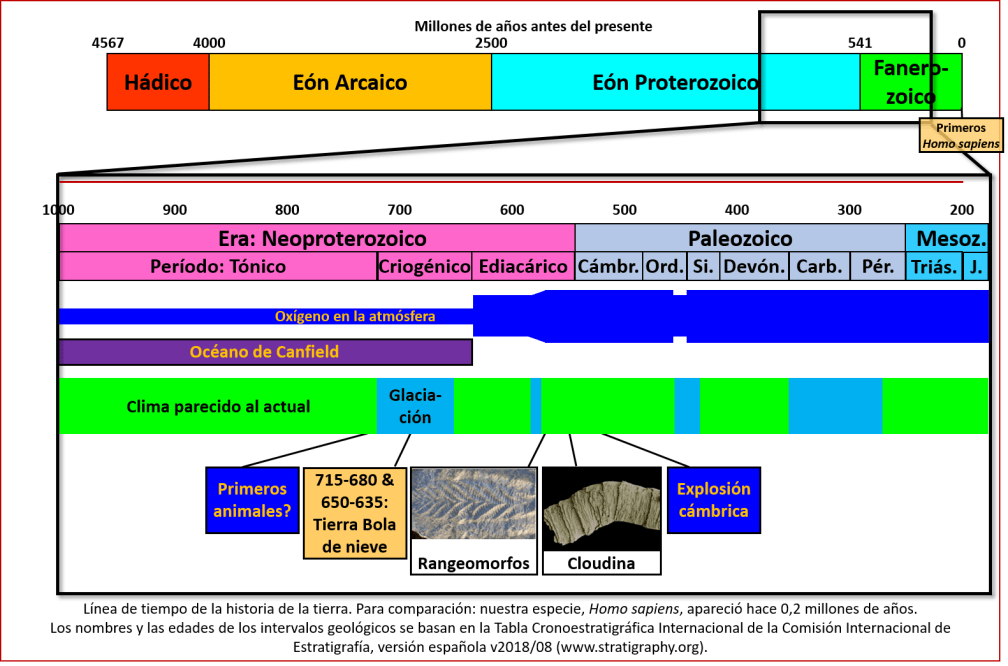
Los océanos tampoco contenían mucho oxígeno durante buena parte del Proterozoico. En efecto, aparte de las aguas más someras, los océanos y los mares experimentaron condiciones euxínicas, es decir, sulfúricas y anaeróbicas, lo que se ha denominado el “Océano de Canfield” (ver la entrega anterior). Esta situación persistió desde hace 1800 millones de años hasta finales del Proterozoico, o sea, durante más de mil millones de años, aunque con fluctuaciones en la extensión de las aguas anaeróbicas [5] y con alternancia entre fases de condiciones euxínicas y condiciones ferruginosas (anaeróbicas con presencia de hierro) [6]. Hasta por lo menos hace 742 millones de años los océanos eran anaeróbicos, y antes de que se oxigenaran eran ferruginosos [7].
Tal situación en los océanos afectó al desarrollo de la vida. Los eucariontes (aquellos organismos cuyas células tienen un núcleo), y especialmente los eucariontes multicelulares, vieron estancada su evolución. Tal como se comentó en la entrega anterior, existen múltiples hipótesis para esto. Los organismos procariontes lograron mantener su hegemonía, e inclusive es posible que ni les dejaron nichos a los eucariontes para que éstos se desarrollaran [8].
Sólo a finales del Proterozoico empezó la diversificación de los eucariontes. Esta diversificación estuvo marcada por la aparición de los animales, de la que hablaremos a continuación, y fue posible gracias – en gran medida – a la oxigenación de los océanos.
La causa de esta oxigenación no está del todo clara, pero parece que jugó un papel importante la disponibilidad de fósforo en los mares. La presencia de sedimentos ricos en fósforo, con una edad de 800-700 millones de años, indica que había un pulso de influjo de este elemento, posiblemente como consecuencia de actividad tectónica. El fósforo es un elemento crítico para el desarrollo de la vida, ya que los organismos lo necesitan – aunque en cantidades mínimas – y normalmente hay poco fósforo libre en el ambiente. Pero si hubo un aumento fuerte en la cantidad de fósforo libre en los océanos, pudo haberse multiplicado la cantidad de organismos y, por ende, la generación de oxígeno por los mismos. Esta generación de oxígeno puede haber resultado en el aumento de la proporción de oxígeno en el aire y el agua, a finales del Proterozoico [9].

Bola de nieve
Hacia finales del Proterozoico, desde hace unos 720 hasta hace 635 millones de años (un período llamado acertadamente el Criogénico), se depositaron rocas típicas de condiciones de capas de hielo en distintas partes del mundo, incluyendo áreas cerca del ecuador. Esto, conjuntamente a valores isotópicos del carbono anómalos, indica que ocurrieron en aquel entonces unas glaciaciones (edades del hielo) que englobaron prácticamente el planeta entero: la sturtiana y la marinoana, ambas con una duración de unos veinte millones de años [10]. Así como pasó al inicio del Proterozoico (ver la entrega del 18 marzo 2019, La Gran Oxidación), la tierra se había vuelto de nuevo una “bola de nieve”, cubierta de capas de hielo que, por lo menos en ciertos momentos, llegaron cerca del ecuador [11]. Las capas de hielo cubrieron tanto los continentes como buena parte de los océanos[12]. Las temperaturas pudieron haber bajado a -50°C en todo el planeta – un frío que hoy en día sólo es común en la Antártida [13].
La causa de las glaciaciones criogénicas puede haber sido la actividad tectónica del planeta. Durante la mayor parte del Proterozoico hubo un solo súper-continente: uno inicial, denominado Nuna, y otro sucesivo, llamado Rodinia. A finales del Proterozoico Rodinia empezó a fragmentarse, resultando en lo que pasaron a ser los núcleos de los continentes que conocemos en la actualidad (ver imagen) [14]. Esto puede haber resultado en cambios en la composición atmosférica y de los océanos, que pueden haber causado la edad de hielo [15]. Por ejemplo, al encontrarse los continentes mayormente en las zonas tropicales del planeta, cálidas y húmedas, una intensa erosión de rocas silíceas puede haber resultado en una reducción del dióxido de carbono en la atmósfera, y por ende, una fuerte bajada en la temperatura [16]. Sin embargo, por sí sola la reducción de CO2 probablemente no fue suficiente para causar la edad de hielo [17].

Una vez que las capas de hielo cubrieran buena parte de la tierra, las condiciones glaciares se podían mantener por mucho tiempo, debido a una combinación de una alta reflectividad (albedo) del planeta, o sea, el hielo reflectaba mucha de la radiación (incluyendo el calor) proveniente del sol, y de una baja concentración de CO2 en la atmósfera [18].
Sin embargo, las capas de hielo probablemente nunca llegaron a cubrir toda la superficie terrestre. Indicios en contra de una glaciación de gran envergadura, incluyen un modelo del oxígeno y el carbono en la atmósfera y el océano, el cual establece que, cuando el agua del mar se enfrió al inicio de la glaciación, ésta absorbió más oxígeno, lo que resultó en la precipitación de sedimentos ricos en carbono y la expulsión a la atmósfera de grandes cantidades de CO2 – potencialmente suficiente para impedir que se desarrollara una glaciación “bola de nieve” [19].
Tampoco eran ininterrumpidas las glaciaciones: se ha encontrado, dentro de la secuencia sedimentaria atribuible a las capas de hielo de tanto la glaciación sturtiana como la marinoana, rocas depositadas en un ambiente de mar abierto, sin hielo. Esto indica que, durante ciertos intervalos, por lo menos algunas partes del planeta no estuvieron cubiertas por capas de hielo [20].
Esta alternancia de intervalos más fríos y más cálidos está reflejada también en las variaciones en la composición isotópica del carbono en las rocas calcáreas formadas antes de, y durante las glaciaciones. Esta composición isotópica está relacionada con cambios en el nivel del mar, que varía a la medida que cambia la intensidad de las glaciaciones: durante las glaciaciones baja el nivel del mar, al convertirse mucha agua en hielo en los continentes [21].

El final de las glaciaciones puede haber sido abrupto. La presencia, en muchos lugares, de una capa de rocas carbonatadas (calcáreas) por encima de las rocas depositadas durante las glaciaciones (tanto la sturtiana como la marinoana; ver imagen), indica que éstas terminaron, probablemente, debido a un aumento de la actividad volcánica y, por ende, la cantidad de dióxido de carbono (CO2) en la atmósfera (la hipótesis original de la tierra bola de nieve [22] dio una explicación un poco distinta, relacionada a la erosión de rocas silíceas, pero ésta ha sido puesta en duda [23]). El aumento en CO2 está reflejado en cambios en las relaciones isotópicas de no sólo el carbono, sino también el oxígeno [24]. Tal vez jugaron un papel también otros gases invernadero (y el vapor de agua, proveniente de las antiguas capas de hielo [25]), ya que el aumento del CO2 posiblemente no fue suficiente para explicar la desaparición de las capas de hielo [26]. También influyó probablemente la presencia de nubes, que actúan como un manto y conservan el calor del planeta [27]. Todo esto causó un importante aumento de la temperatura y, por tanto, la desaparición de las capas de hielo [28]. Las rocas calcáreas son diacrónicas, o sea, no se formaron en el mismo tiempo en todos los lugares; esto indica que, a la medida que las capas de hielo se derritieran, lo que en unos lugares ocurrió antes que en otros, empezaron a formarse los carbonatos [29].
Durante las glaciaciones criogénicas, los océanos se mantuvieron euxínicos (o sea, sulfúricos y anaeróbicos), tal como en buena parte del Proterozoico (ver arriba). Además, al estar cubiertos mayormente de capas de hielo, probablemente contenían poco oxígeno. Sólo al terminar las glaciaciones, las aguas profundas oceánicas empezaron a mezclarse con aguas más dulces y oxigenadas provenientes de los continentes, y terminaron las condiciones euxínicas [30]. Si había hierro en el agua oceánica euxínica, éste se quedaba en solución, hasta la reaparición del oxígeno, que hizo precipitar el hierro como depósitos ferruginosos en el fondo marino [31].
Organismos en la bola de nieve
Durante la mayor parte del Proterozoico, los ecosistemas en nuestro planeta estaban dominados, tal como vimos en la entrega anterior, por los organismos unicelulares, mientras que los eucariontes (los organismos cuyas células tienen un núcleo, y que incluyen los organismos multicelulares) ocupaban un lugar secundario. Había organismos multicelulares, pero eran pocos. Sin embargo, en el Neoproterozoico, la última era del Proterozoico, esto empezó a cambiar, ya antes de las glaciaciones del Criogénico. Hace alrededor de 800 millones de años empezaron a aparecer amebas (eucariontes unicelulares acuáticos, del reino de protistas) con un envoltorio duro, cuyos fósiles se han encontrado en rocas de esos tiempos de varias partes del mundo (ver imagen) [32]. Los envoltorios (denominados testas) tenían forma de vaso, y podían estar compuestos distintos materiales: de sílice o de material orgánico (a veces mezclado con granos de cuarzo) [33]. Son los fósiles más antiguos conocidos que se pueden utilizar para dataciones, ya que sus formas cambiaron en el tiempo de manera que, al encontrar una de estas amebas fósiles y observar su forma, se puede determinar cuándo vivió [34]. La radiación de estos, y otros, protistas al inicio del Neoproterozoico puede haber estado causado por su novedosa manera de alimentación: la ingesta de otros eucariontes [35].

Pero hasta allí llegó, por los momentos, la evolución de los eucariontes. Poco antes de las glaciaciones del Criogénico ocurrió un cambio importante en los ecosistemas oceánicos: organismos planctónicos eucariotas (entre otros, los llamados acritarcos) fueron reemplazados por eucariontes más simples y bacterias. Sin embargo, se determinó que este cambio no fue causado por el inicio de las glaciaciones, sino por una reducción del oxígeno en los océanos [36].
Una vez empezadas las glaciaciones del Criogénico, la vida en todo el planeta se vio sin duda afectada. Deben haber sido condiciones complicadas para la supervivencia de los organismos, aun en el caso de que no toda la tierra estuviera cubierta por capas de hielo. Los eucariontes aparecieron hace poco más 2000 millones de años (ver la entrega anterior), y se mantuvieron hasta el día de hoy, así que por lo menos algunos grupos de eucariontes sobrevivieron a las glaciaciones. Las amebas con testas se conservaron (ver imagen). Pero los organismos que vivían en aguas someras deben haber sido afectados fuertemente. El mejor sitio para sobrevivir a las glaciaciones del Criogénico debe haber sido las fuentes hidrotermales en el fondo de los océanos (ver la entrega del 15 diciembre 2018, Amanecer con una nueva luz), pero allí dominaban los procariontes [37]. ¿Dónde, entonces, pueden haber sobrevivido los eucariontes?
Se ha calculado que, aun en el caso de una verdadera tierra bola de nieve, cubierta por completo de capas de hielo, puede haber habido cuerpos de agua sin hielo: mares internos parecidos al actual Mar Rojo pueden haberse mantenido libres de hielo por varios millones de años. En tal caso actuaron como refugio para organismos [38]. También pueden haber actuado como refugio los océanos ecuatoriales que sólo estaban cubiertos por una delgada capa de hielo, o mares en la cercanía de islas volcánicas o las fuentes hidrotermales [39].
También durante las glaciaciones ocurrieron cambios en las formas de vida: los organismos que se encontraron en las rocas carbonáticas que se depositaron justo después de las glaciaciones, pertenecen a especies distintas a las que dominaron antes de que la tierra se enfriara. Por ejemplo, después de la glaciación sturtiana (la primera de las dos) se encontraron los primeros probables foraminíferos conocidos (foraminíferos son eucariontes unicelulares protistas, relacionados a las amebas) [40], y aparecieron las algas marinas, que también son eucariontes [41]. Por otro lado, se encontraron también amebas, que ya eran comunes antes del Criogénico [42], y ejemplares de Obruchevella, una cianobacteria conocida de tanto antes como después del Criogénico [43]. Hacia finales del Criogénico, posiblemente ya antes de la última glaciación, empezaron ya a aparecer las primeras esponjas [44] – representantes de un grupo de organismos completamente nuevos: los animales, de los que hablaremos a continuación.
Un cambio importante que se dio al finalizar las glaciaciones, es que los procariontes (principalmente bacterias) perdieron su hegemonía en la faz de la tierra. Aparecieron las algas, eucariontes, que reemplazaron en buena parte a los procariontes, cuya abundancia relativa cayó fuertemente, posiblemente debido a la aparición de depredadores protistas, tales como los foraminíferos ya mencionados [45]. Esto cambió de manera profunda a los ecosistemas, lo que puede haber contribuido a la posterior radiación de los animales [46].
Después del hielo
Al terminar las glaciaciones del Criogénico, al inicio del Ediacárico hace 635 millones de años (ver línea de tiempo), ocurrió una importante fase de oxigenación [47] y empezó la diversificación de los animales [48]. Pulsos de oxigenación de los océanos en el Ediacárico coincidieron con aumentos en la diversidad de los animales [49]. ¿Coincidencia? Probablemente no.
El oxígeno en los océanos no estaba distribuido de manera homogénea: se concentró en la parte superior de la columna de agua. Las partes profundas de los océanos se mantuvieron anóxicas durante mucho tiempo (hasta hace 580 millones de años, al final del Proterozoico [50]), con zonas intermedias ferruginosas [51]. Los ecosistemas se quedaron principalmente en las zonas someras, bien oxigenadas, resaltando la importancia de una alta concentración de oxígeno para que prosperaran los organismos [52]. Además del oxígeno, puede haber jugado un papel importante en el desarrollo de los animales la salinidad de los océanos: hasta finales del Proterozoico ésta era muy alta, de manera que, según una hipótesis, los animales sólo podían vivir en ciertas zonas de baja salinidad – por ejemplo, cerca de las desembocaduras de los ríos; cuando empezó a bajar la salinidad, los animales pudieron colonizar los mares del mundo entero, resultando en un fuerte aumento de las especies de los animales [53].
El nexo entre las glaciaciones, el oxígeno y la vida puede haber sido el fósforo. El fósforo es un elemento clave para el desarrollo de los organismos vivientes: sólo lo necesitan en pequeñas cantidades, pero por ejemplo el aparato energético de la célula depende del fósforo. Cuando el fósforo no es abundante en el ambiente, puede ser un factor limitante en el desarrollo de la vida; y esto es precisamente que se piensa que ocurrió en el Proterozoico. Pero cuando, e finales del Proterozoico, las capas de hielo del Criogénico cubrieron los continentes, éstas causaron una fuerte erosión de las rocas terrestres, lo que resultó en un influjo de grandes cantidades de detrito continental en los océanos cuando terminaron las glaciaciones. Este detrito era rico en minerales, lo que resultó en un fuerte aumento en la disponibilidad de fósforo en el agua. Esto causó una explosión de la cantidad de organismos, y por ende, en la producción de oxígeno mediante la fotosíntesis (el mecanismo que tienen muchos organismos para convertir la energía de la luz del sol en energía). Como consecuencia, aumentó la concentración de oxígeno en el agua y la atmósfera, lo que permitió que se desarrollaran nuevos grupos de organismos – en particular, los animales [54].
Los animales
Los animales conforman el reino Animalia (o Metazoo). Son organismos eucariontes multicelulares, caracterizados por su capacidad de moverse. Todos los animales (con la excepción de las esponjas y los ctenóforos) tienen múltiples tipos de tejidos, y sus cuerpos son caracterizados por una simetría bilateral. Se alimentan de otros organismos, y no son capaces de realizar fotosíntesis [55].
Los primeros animales, según estudios filogenéticos que reconstruyeron el último antecesor común de los animales actuales a partir de sus genomas, aparecieron justo antes del Criogénico, mientras que su radiación se dio después de las glaciaciones [56]. No sabemos cuál fue este primer animal, pero sí se puede deducir el árbol genealógico de los animales a partir de datos filogenéticos y otros indicios, y determinar cuál fue el primer grupo de animales que se separó del linaje de los demás animales, y que por tanto se considera más próximo, en forma y comportamiento, al primer animal ancestral. Desde el punto de vista genético, se pudo determinar que los mecanismos que regulan la expresión de los genes de los animales ya estaban establecidos en los primeros animales [57].
Bueno, en la realidad se ha dado, y todavía sigue, un intenso debate entre los paleontólogos (los que estudian los organismos que poblaron la tierra en el pasado). Según ciertos autores, los primeros animales fueron las esponjas, que – a diferencia de los demás animales – no tienen una diferenciación entre tejidos, ni nervios [58]. Esto está soportado, además, por datos de moléculas biológicas típicas de las esponjas, encontradas en rocas del inicio del Ediacárico [59].
Sin embargo, según otros estudios filogenéticos fueron los ctenóforos (animales parecidos a las medusas) los animales más antiguos [60]. Pero no se ha encontrado hasta la fecha restos fósiles que puedan dar soporte a esta hipótesis. Sólo se conocen fósiles de ctenóforos desde el inicio del Cámbrico, el período sucesivo al Proterozoico [61].
Más recientemente se determinó que también son extremadamente primitivos los placozoos, un grupo que hoy en día cuenta con un solo representante, Trichoplax adhaerens, un animal marino de forma globular que se asemeja a las amebas y que carece de órganos y de la mayoría de los tejidos [62]. Por su forma primitiva y otras características se ha propuesto que los placozoos pudieran ser los animales más primitivos [63], pero en tal caso habría que suponer que las esponjas, hoy en día los animales más simples, provengan de un ancestro que en su momento era más complejo.
Sea como fuere, los animales sin simetría bilateral (o sea, las esponjas, los ctenóforos, y los placozoos) parecen ser los animales más viejos. Los Bilateria (todos los demás animales, incluyendo a nosotros, los humanos, que tenemos una simetría bilateral), vinimos después.
En cuanto al acervo genético de los primeros animales: la aparición del éstos ha ido de la mano del desarrollo de genes nuevos, específicos de los animales. Pero obviamente se mantuvieron la gran mayoría de los genes preexistentes, aunque muchos con modificaciones [64].
Una característica de muchos animales es que presentan algún tipo de biomineralización. O sea, tienen partes duras, tales como una concha, un esqueleto, etc. Los primeros animales no tenían partes duras y por tanto, tal como veremos a continuación, es difícil encontrar sus restos fosilizados, ya que son las partes duras las que normalmente quedan fosilizadas. Pero los inicios de biomineralización ya se dieron, al parecer, antes de que aparecieran los primeros animales, y antes de las glaciaciones del Criogénico, hace unos 810 millones de años: se trata de estructuras de apatito (un fosfato) que cubrían un organismo eucariota unicelular para protegerlo – lo que sugiere que la cantidad de fósforo en el ambiente ya empezó a aumentar antes de las glaciaciones criogénicas [65].
El Ediacárico
El período de la primera florescencia de los animales es el Ediacárico [66], llamado así por el yacimiento paleontológico de Ediacara en Australia, donde se encontraron (y se siguen encontrando [67]) los fósiles de una multitud de animales y otros organismos, todos de cuerpo blando [68]. A pesar de que estos organismos no tenían partes duras, están bien preservados, lo que se debe a un proceso especial de fosilización [69]. Colectivamente, estos fósiles se conocen como la fauna de Ediacara. Posteriormente se encontraron otros yacimientos importantes de esta edad, especialmente en la China [70], pero el nombre de Ediacara se ha mantenido para denominar a toda esta fauna y a este período. El Ediacárico duró desde el final de las glaciaciones del Criogénico (hace 635 millones de años) hasta el inicio del Cámbrico (hace 541 millones de años), cuando aparecieron los animales con partes duras (ver línea de tiempo) [71]. La radiación de los animales tomó vuelo después de una última glaciación, la de Gaskiers (hace 580 millones de años), cuando los océanos se volvieron más oxigenados [72]. Los océanos más profundos se quedaron anóxicos durante más tiempo (ver arriba), y fue sólo después de que éstos se oxigenaran también, que los animales pudieron colonizar las aguas profundas [73].

La aparición de la fauna de Ediacara ocurrió, entonces, hace unos 575 millones de años. Fue una diversificación relativamente abrupta: en menos de veinte millones de años aparecieron una multitud de formas de animales. Esta primera diversificación de los animales ha sido denominada la “Explosión de Avalon” por algunos autores [74].
La vida en el Ediacárico ha sido llamada el “jardín de Ediacara” (ver imagen) [75]. Fue un período dentro de todo pacífico. La vida estuvo concentrada en los mares, específicamente los someros. En el fondo marino prosperaban las alfombras de algas (ver la entrega del 12 agosto 2018, Los primeros organismos). Sobre éstas, y flotando en el agua, vivían grandes cantidades de protozoos rizópodos: eucariontes unicelulares tales como las amebas y los foraminíferos (ver arriba), que se alimentaban principalmente del material orgánico en el agua. Los metazoos (es decir, los animales) todavía jugaban un papel secundario, pero ya habían desarrollado distintas formas. Algunas de estas formas eran precursoras de los filos (linajes) actuales, otras no se parecen para nada a los organismos posteriores y pueden haber pertenecido a linajes extintos. Los animales tenían cuerpos blandos, sin caparazones de ningún tipo: aun no había depredadores de los cuales había que protegerse (éstos aparecerían después, en el Cámbrico), y en efecto, los animales sólo se alimentaban de las algas o del material orgánico en el agua y en el fondo marino [76]. Las partículas de material orgánico suspendidas en el agua podían ser absorbidas mediante osmosis pasiva, o ingeridas mediante alimentación por filtración, más o menos activamente [77]. Los ecosistemas pueden haber sido variados, con distintos organismos en nichos ecológicos distintos, con una variedad de maneras de vivir y alimentarse [78].

Entre los primeros animales del Ediacárico se encuentran los rangeomorfos: organismos modulares, ramificados, de una forma parecida a una pluma o la fronda de un helecho (ver imagen). Eran sésiles (o sea, no se desplazaban), y vivían sobre el fondo marino, desde zonas costeras hasta una profundidad de 2000 metros [79]. Se ha postulado que los rangeomorfos vivían inicialmente en las aguas profundas, donde las condiciones (temperatura, disponibilidad de oxígeno, etc.) eran más estables, y que sólo después de varios millones de años migraron hacia las aguas más someras, cuando el oxígeno allí se mantuvo más estable en el tiempo [80]. Probablemente se alimentaban filtrando moléculas orgánicas del agua (que en aquel tiempo eran más abundantes que actualmente) mediante osmosis [81]. Podían cambiar de forma y tamaño (alcanzaban una longitud de hasta dos metros) dependiendo de la cantidad de oxígeno y nutrientes en el agua [82]. La reproducción de los rangeomorfos, tal como se pudo determinar a partir de la distribución de individuos de distintos tamaños en un mismo lugar, era asexual, mediante estolones (como las fresas) y a veces mediante propágulos (que permiten que los descendientes se alejen más de los progenitores, como en el caso de las patatas) [83].
Posteriormente, empezaron a aparecer otros animales. Entre éstos había esponjas que vivían sobre las alfombras de algas, pólipos que nadaban en el agua, y moluscos sin concha, como Kimberella (o Kimberia) [84]. Invertebrados tubulares, hasta 80 cm de largo, vivían en grupos fijados al fondo marino; probablemente se trataba de invertebrados, similares a gusanos [85]. Algunos animales se alimentaban del material orgánico en el agua [86]; otros pastaban en las alfombras de algas. Inicialmente, los animales del Ediacárico eran sésiles; sólo hacia finales del período empezaron a moverse, tal como nos muestra la aparición de trazas fósiles [87].

Un grupo típico del Ediacárico, cuya relación filogenética con otros grupos de organismos no está clara, es Dickinsonia (ver imagen): formas elipsoides, planas, con un largo de hasta 140 cm y una estructura radial. Estudios biológicos [88] y geoquímicos [89] indican que probablemente se trata de animales, que habitaban el fondo marino (una interpretación alternativa, poco aceptada, es que eran un tipo de líquenes, y que vivían en tierra [90]). Eran animales únicos, pertenecientes a un linaje primitivo (aunque menos primitivo que las esponjas), ahora desaparecido [91]. Las trazas que dejaron en el fondo marino indican que las Dickinsonia se alimentaban de las alfombras de algas, y que eran capaces de moverse para buscar nuevos pastos [92].
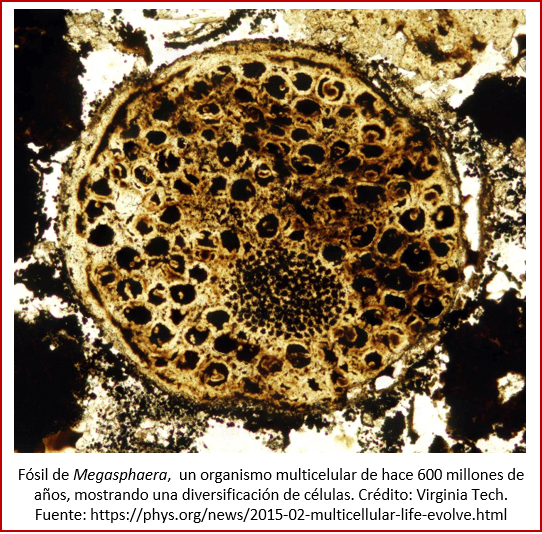
Enigmática es también la naturaleza de ciertos glóbulos multicelulares, con diámetros de menos de un milímetro, entre los que se encuentra Megasphaera (ver imagen) [93], que fueron interpretados como las formas embrionarias de ciertos animales, o quistes de protistas [94], o bacterias sulfúricas gigantes [95].
Así como muchos animales del Ediacárico difícilmente pueden ser asignados a alguno de los filos actuales de animales, no se ha encontrado hasta la fecha representantes ediacáricos de muchos de los filos de animales que se volvieron comunes desde el Cámbrico, tales como los artrópodos (p.ej. los cangrejos) y los equinodermos (p.ej. los erizos de mar) [96].

Los organismos del Ediacárico son tan distintos de los actuales que es difícil entender cómo vivieron, al ser prácticamente imposible relacionar muchos de estos organismos a grupos de organismos actuales. Ha sido necesario emplear enfoques novedosos para entender los estilos de vida de los organismos. Por ejemplo, para entender el estilo de vida de Parvancorina, un animal de pocos centímetros de forma triangular (ver imagen), se hizo un modelado hidrodinámico, que indicó que el organismo probablemente era capaz de moverse para orientarse dependiendo de dónde venía la corriente de agua, y que probablemente se nutría de detrito orgánico en el agua [97]. Algo parecido se hizo para Ermietta (ver imagen), cuyas formas y manera de vivir (agrupada con otras Ermietta) sirvieron – según un modelado realizado recientemente – para maximizar la cantidad de agua que podía procesar para filtrar restos orgánicos en suspensión [98].

Llama la atención la gran dimensión de muchos organismos ediacáricos, que alcanzaban longitudes de hasta más de un metro, Se ha propuesto que esto se debió a la necesidad de tener acceso a aguas con más oxígeno o nutrientes. Sin embargo, esto no parece haber sido la principal causa, y se ha propuesto que una altura grande es conveniente para que los descendientes puedan alejarse más de su progenitor [99].
No sólo entre los animales, sino también entre los otros dominios de la vida aparecieron especies nuevas en el Ediacárico. En el caso de las algas, por un lado desaparecieron las alfombras de algas que habían dominado la vida desde que apareciera en el Arcaico, pero por otro, aparecieron algas marinas parecidas a las que conocemos hoy en día [100]. También aparecieron organismos globulares, tales como Beltanelliformis, que pudieron ser identificados como colonias de cianobacterias gracias a restos orgánicos encontrados en algunos fósiles de este organismo [101].
Hacia finales del Ediacárico desaparecieron las alfombras de algas de buena parte de los mares (excepto los más inhóspitos para la vida animal), debido, por lo menos en parte, a la actividad de los animales devoradores de las algas [102]. Al desaparecer las alfombras de algas, quedó expuesto el fondo marino y pudieron empezar gusanos y otros animales a revolver los sedimentos del fondo marino, oxigenándolo y así creando nuevos nichos ecológicos. Esto ha sido llamado la “revolución agronómica” [103]. Los gusanos vivían, por lo menos parte del tiempo, por debajo del fondo marino, y se alimentaban de materia orgánica; no se han preservado sus restos, pero sí se pueden reconocer las trazas que dejaban al desplazarse por el sedimento [104]. Mientras que las primeras trazas fósiles de animales eran las huellas dejadas por animales desplazándose por encima del fondo marino [105] (pero algunas de estas trazas pueden haber sido causadas por microbios [106]), a partir de la revolución agronómica los gusanos empezaron a hacer túneles verticales, en forma de “J” o “U”, penetrando el fondo marino hasta unos cuatro centímetros [107]. Otros gusanos dejaron trazas irregulares con un diámetro de menos de un milímetro, lo que indica que deben haber sido realmente delgados, parecido en espesor a un cabello humano [108].
De esta manera se redistribuyó la materia orgánica en el jardín de Ediacara, abriendo nuevos nichos ecológicos, ofreciendo la oportunidad a organismos nuevos de desarrollarse [109].
El final del Ediacárico
Los tiempos del “jardín de Ediacara” llegaron a su fin cuando apareció un nuevo tipo de organismo: los depredadores. (Esto puede explicar por qué los gusanos mencionados arriba empezaron a vivir dentro del sedimento en lugar de por encima de éste: no sólo para alimentarse, sino también para protegerse.)
Aparecieron, durante los últimos millones de años del Ediacárico, los primeros organismos con esqueletos calcáreos – algo del que se pensó que ocurriría sólo en el siguiente período, el Cámbrico. El organismo Namacalathus, que a primera vista asemeja un coral pero que en la realidad era un animal complejo, tenía un esqueleto, tal vez como uno de los primeros animales a tenerlo [110]. Otro animal de esos tiempos con un esqueleto – en este caso externo – era Cloudina (ver imagen). Los animales con esqueleto pudieron desarrollarse desde hace unos 545 millones de años, cuando los océanos se oxigenaron los suficiente para que contuvieran calcita (que se utiliza para los esqueletos) en lugar de otro carbonato, la dolomita [111]. Pero, puesto que el desarrollo de los esqueletos externos debe obedecer a una buena razón, se ha sugerido que el causante fue la aparición de los organismos depredadores (ver la próxima entrega).

También aparecieron los primeros organismos con ojos. De nuevo, se ha postulado que esto se debió a la nueva dinámica, de una interacción entre depredadores y presas [i].
Estos cambios marcaron el final del Ediacárico, y el inicio del Cámbrico. La vida en la tierra se transformó por completo: en el Cámbrico aparecieron los linajes de los animales que hoy en día están poblando la faz de nuestro planeta, ricos en variedad de formas, muchos con partes duras, tales como conchas, esqueletos, etcétera. Esta transformación ha sido llamada la “Explosión Cámbrica”, o, más científicamente, la radiación evolutiva del Cámbrico [ii].
Fue de verdad una transformación de gran envergadura, una revolución en el reino animal (y, por consecuencia), los otros reinos de la vida. Sin embargo, ciertos linajes ediacáricos no desaparecieron durante esta transformación.
Durante mucho tiempo se pensó que la gran mayoría de los animales del Ediacárico, sólo existieron durante este período y que desaparecieron sin dejar especies descendientes antes de que empezara el siguiente período, el Cámbrico. Sin embargo, un estudio filogenético exhaustivo de Stromatoveris, un animal cámbrico recién encontrado en la China, indica que éste perteneció al mismo grupo de animales como los rangeomorfos y Dickinsonia. Así que no todas las especies ediacáricas desaparecieron al final de este período [iii]. Todo esto implica que la transición del Ediacárico al Cámbrico puede haber sido menos abrupta de lo que se ha postulado [iv].
Conclusión
El Proterozoico fue un eón largo, con una duración de 2000 millones de años, en el que ocurrieron varios acontecimientos transcendentales para la historia de la tierra, separados por intervalos, “aburridos”, en los que poco parecía pasar. Al final del Proterozoico se dio un evento clave en la historia de la tierra, con un paralelismo sorprendente con los acontecimientos al inicio del Proterozoico: ocurrió una explosión de la vida, marcada por la aparición de los animales, acompañada de la más extrema edad de hielo que conoció nuestro planeta, y el segundo gran aumento de la proporción de oxígeno en la atmósfera.
Las glaciaciones del Criogénico prepararon el camino para que el aumento en la proporción de oxígeno, que a su vez hizo posible el desarrollo de organismos multicelulares complejos: en particular, los animales. En el período sucesivo, el Ediacárico, aparecieron una variedad de animales, todos marinos y de cuerpos blandos, que se alimentaban de materia orgánica en el agua y de las alfombras de algas en el fondo del mar. Este ecosistema pacífico, denominado el “Jardín de Ediacara”, llegó a su fin con la aparición de los primeros depredadores, que causó grandes cambios en los animales. Estos cambios marcaron el inicio del siguiente eón, el Fanerozoico, en el que todavía nos encontramos hoy en día.
Estos cambios, denominados la Explosión Cámbrica por su carácter bastante abrupto, pusieron fin a unos tres mil millones de años de lo que pudiéramos llamar la infancia de la vida. Hablaremos de esto en la próxima entrega, con la que terminaremos esta serie de entregas sobre el desarrollo de la vida en la tierra.
Nota: la imagen en el encabezado de esta entrega es una impresión artística del Jardín de Ediácara. Crédito: Ryan Somma, CC BY-SA. Fuente: http://theconversation.com/reverse-engineering-mysterious-500-million-year-old-fossils-that-confound-our-tree-of-life-78229.
[i] Parker, A., 2003. In the blink of an eye: How vision kick-started the big bang of evolution. The Free Press, Simon & Schuster UK Ltd.
[ii] Ver: https://es.wikipedia.org/wiki/Explosi%C3%B3n_c%C3%A1mbrica.
[iii] Hoyal Cuthill, J.F. y Han, J., 2018. Cambrian petalonamid Stromatoveris phylogenetically links Ediacaran biota to later animals. Palaeontology, 61 (6), 813-823. https://onlinelibrary.wiley.com/doi/full/10.1111/pala.12393.
[iv] Zhu, M., Zhuravlev, A.Y., Wood, R.A., Zhao, F. y Sukhov, S.S., 2017. A deep root for the Cambrian explosion: Implications of new bio- and chemostratigraphy from the Siberian Platform. Geology, 45 (5), 459-462. https://doi.org/10.1130/G38865.1. Wood, R.A., 2019. The rise of animals. Scientific American, junio 2019, 18-25. www.ScientificAmerican.com.
[1] Parnell, J., Boyce, A.J., Mark, D., Bowden, S. y Spinks, S., 2010. Early oxygenation of the terrestrial environment during the Mesoproterozoic. Nature, 468, 290-293. www.nature.com/articles/nature09538.
[2] Canfield, D.E. y Teske, A., 1996. Late Proterozoic rise in atmospheric oxygen concentration inferred from phylogenetic and sulphur-isotope studies. Nature, 382, 127-132. https://www.nature.com/articles/382127a0.
[3] Blamey, N.J.F., Brand, U., Parnell, J., Spear, N., Lécuyer, C., Benison, K., Meng, F. y and Ni, P., 2016. Paradigm shift in determining Neoproterozoic atmospheric oxygen. Geology, 44 (8), 651-654. http://geology.gsapubs.org/content/44/8/651.full.pdf.
[4] Williams, J.J., Mills, B.J.W. y Lenton, T.M., 2019. A tectonically driven Ediacaran oxygenation event. Nature Communications, 10, 2690. https://doi.org/10.1038/s41467-019-10286-x.
[5] Canfield, D.E., 1998. A new model for Proterozoic ocean chemistry. Nature, 396, 450-453. www.nature.com/articles/24839. Poulton, S.W., Fralick, P.W. y Canfield, D.E., 2004. The transition to a sulphidic ocean 1.84 billion years ago. Nature, 431, 173-177. www.nature.com/articles/nature02912. Poulton, S.W., Fralick, P.W. y Canfield, D.E., 2010. Spatial variability in oceanic redox structure 1.8 billion years ago. Nature Geoscience, 3, 486-490. www.nature.com/articles/ngeo889.
[6] Boyle, R.A., Clark, J.R., Poulton, S.W., Shields-Zhou, G., Canfield, D.E. y Lenton, T.M., 2013. Nitrogen cycle feedbacks as a control on euxinia in the mid-Proterozoic ocean. Nature Communications, 4, 1533. www.nature.com/articles/ncomms2511. Reinhard, C.T. y otros, 2013. Proterozoic ocean redox and biogeochemical stasis. Proceedings of the National Academy of Sciences, 110 (14), 5357-5362. https://www.pnas.org/content/110/14/5357.
[7] Johnston, D.T., Poulton, S.W., Dehler, C., Porter, S., Husson, J., Canfield, D.E. y Knoll, A.H., 2010. An emerging picture of Neoproterozoic ocean chemistry: Insights from the Chuar Group, Grand Canyon, USA. Earth and Planetary Science Letters, 290 (1–2), 64-73. https://doi.org/10.1016/j.epsl.2009.11.059.
[8] Fedonkin, M.A., 2003. The origin of the Metazoa in the light of the Proterozoic fossil record. Paleontological Research, 7 (1), 9-41. https://doi.org/10.2517/prpsj.7.9.
[9] Papineau, D., 2010. Global biogeochemical changes at both ends of the Proterozoic: Insights from phosphorites. Astrobiology, 10, 165-181. www.liebertpub.com/doi/10.1089/ast.2009.0360. Reinhard, C.T. y otros, 2017. Evolution of the global phosphorus cycle. Nature, 541, 386-389. www.nature.com/articles/nature20772.
[10] Ver: https://en.wikipedia.org/wiki/Marinoan_glaciation.
[11] Kirschvink, J.L., 1992. Late Proterozoic Low-Latitude Global Glaciation: The Snowball Earth. En: Schopf, J. y Klein, C. (editors), In the Proterozoic Biosphere: A Multidisciplinary Study; 51-52. Cambridge University Press. https://authors.library.caltech.edu/36446/1/Kirschvink_1992p51.pdf. Hoffman, P.F., Kaufman, A.J., Halverson, G.P. y Schrag, D.P., 1998. A Neoproterozoic Snowball Earth. Science, 281, 1342-1346. https://science.sciencemag.org/content/281/5381/1342.
[12] Domack, E.W. y Hoffman, P.F., 2010. An ice grounding-line wedge from the Ghaub glaciation (635 Ma) on the distal foreslope of the Otavi carbonate platform, Namibia, and its bearing on the snowball Earth hypothesis. GSA Bulletin, 123 (7-8), 1448-1477. https://doi.org/10.1130/B30217.1.
[13] Hoffman, P.F. y Schrag, D.P., 2000. Snowball Earth. Scientific American, January 2000, 68-75. www.scientificamerican.com.
[14] Cawood, P.A. y Hawkesworth, C.J., 2014. Earth’s middle age. Geology, 42 (6), 503-506. https://doi.org/10.1130/G35402.1.
[15] Stern, R.J. y Miller, N.R., 2018. Did the transition to plate tectonics cause Neoproterozoic Snowball Earth? Terra Nova, 30, 87-94. https://onlinelibrary.wiley.com/doi/epdf/10.1111/ter.12321.
[16] Hoffman, P.F. y Schrag, D.P., 2002. The snowball Earth hypothesis: testing the limits of global change. Terra Nova, 14 (3), 129-155. https://doi.org/10.1046/j.1365-3121.2002.00408.x.
[17] Poulsen, C.J., Pierrehumbert, R.T. y Jacob, R.L., 2001. Impact of ocean dynamics on the simulation of the Neoproterozoic snowball Earth. Geophysical Research Letters, 28 (8), 1575-1578. https://agupubs.onlinelibrary.wiley.com/doi/pdf/10.1029/2000GL012058.
[18] Kirschvink, 1992. Ver nota 11.
[19] Peltier, W.R., Liu, Y. y Crowley, J.W., 2007. Snowball Earth prevention by dissolved organic carbon remineralization. Nature, 450, 813-818. www.nature.com/articles/nature06354.
[20] Allen, P.A. y Etienne, J.L., 2008. Sedimentary challenge to Snowball Earth. Nature Geoscience, 1, 817-825. www.nature.com/articles/ngeo355. Le Heron, D.P., Busfield, M.E. y Kamona, F., 2012. An interglacial on snowball Earth? Dynamic ice behaviour revealed in the Chuos Formation, Namibia. Sedimentology, 60 (2), 411-427. https://doi.org/10.1111/j.1365-3091.2012.01346.x. Le Heron, D.P., Cox, G., Trundley, A. y Collins, A., 2011. Sea ice−free conditions during the Sturtian glaciation (early Cryogenian), South Australia. Geology, 39 (1), 31-34. https://doi.org/10.1130/G31547.1.
[21] Halverson, G.P., Hoffman, P.F., Schrag, D.P., Maloof, A.C. y Rice, A.H.N., 2005. Toward a Neoproterozoic composite carbon-isotope record. GSA Bulletin, 117 (9-10), 1181-1207. https://doi.org/10.1130/B25630.1. Swart, P.K. y Kennedy, M.J., 2012. Does the global stratigraphic reproducibility of δ13C in Neoproterozoic carbonates require a marine origin? A Pliocene–Pleistocene comparison. Geology, 40 (1), 87-90. https://doi.org/10.1130/G32538.1.
[22] Hoffman y otros, 1998. Ver nota 11.
[23] Sansjofre, P., Ader, M., Trindade, R.I.F., Elie, M., Lyons, J., Cartigny, P. y Nogueira, A.C.R., 2011. A carbon isotope challenge to the snowball Earth. Nature, 478, 93-96. www.nature.com/articles/nature10499. Kennedy, M.J., Christie-Blick, N. y Prave, A.R., 2001. Carbon isotopic composition of Neoproterozoic glacial carbonates as a test of paleoceanographic models for snowball Earth phenomena. Geology, 29 (12), 1135-1138. https://doi.org/10.1130/0091-7613(2001)029<1135:CICONG>2.0.CO;2.
[24] Killingsworth, B.A., Hayles, J.A., Zhou, C. y Bao, H., 2013. Sedimentary constraints on the duration of the Marinoan Oxygen-17 Depletion (MOSD) event. Proceedings of the National Academy of Sciences, 110 (44), 17686-17690. www.pnas.org/content/110/44/17686.
[25] Hoffman y Schrag, 2000. Ver nota 13.
[26] Sansjofre y otros, 2011. Ver nota 23.
[27] Abbot, D.S., Voigt, A., Branson, M., Pierrehumbert, R.T., Pollard, D., Le Hir, G. y Koll, D.D.B., 2012. Clouds and Snowball Earth deglaciation. Geophysical Research Letters, 39, L20711. https://doi.org/10.1029/2012GL052861.
[28] Hoffman y otros, 1998. Ver nota 11.
[29] Hoffman, P.F., Halverson, G.P., Domack, E.W., Husson, J.M., Higgins, J.A. y Schrag, D.P., 2007. Are basal Ediacaran (635 Ma) post-glacial “cap dolostones” diachronous? Earth and Planetary Science Letters, 258 (1-2), 114-131. https://doi.org/10.1016/j.epsl.2007.03.032.
[30] Hurtgen, M.T., Halverson, G.P., Arthur, M.A. y Hoffman, P.F., 2006. Sulfur cycling in the aftermath of a 635-Ma snowball glaciation: Evidence for a syn-glacial sulfidic deep ocean. Earth and Planetary Science Letters, 245 (3–4), 551-570. https://doi.org/10.1016/j.epsl.2006.03.026.
[31] Hoffman y Schrag, 2002. Ver nota 16.
[32] Porter, S.M. y Knoll, A.H., 2000. Testate amoebae in the Neoproterozoic Era: evidence from vase-shaped microfossils in the Chuar Group, Grand Canyon. Paleobiology, 26 (3), 360-385. http://dx.doi.org/10.1666/0094-8373(2000)026<0360:TAITNE>2.0.CO;2. Lahr, D.J.G. y otros, 2019. Phylogenomics and morphological reconstruction of Arcellinida testate amoebae highlight diversity of microbial eukaryotes in the Neoproterozoic. Current Biology, 29, 1-11. https://doi.org/10.1016/j.cub.2019.01.078.
[33] Morais, L., Fairchild, T.R., Lahr, D.J.G., Rudnitzki, I.D., Schopf, J.W., Garcia, A.K., Kudryavtsev, A.B. y Romero, G.R., 2017. Carbonaceous and siliceous Neoproterozoic vase-shaped microfossils (Urucum Formation, Brazil) and the question of early protistan biomineralization. Journal of Paleontology, 91(3), 393-406. https://doi.org/10.1017/jpa.2017.16.
[34] Cohen, P.A., Irvine, S.W. y Strauss, J.V., 2017. Vase‐shaped microfossils from the Tonian Callison Lake Formation of Yukon, Canada: taxonomy, taphonomy and stratigraphic palaeobiology. Palaeontology, 60 (5), 683-701. https://doi.org/10.1111/pala.12315. Riedman, L.A., Porter, S.M. y Calver, C.R., 2018. Vase-shaped microfossil biostratigraphy with new data from Tasmania, Svalbard, Greenland, Sweden and the Yukon. Precambrian Research, 319, 19-36. https://doi.org/10.1016/j.precamres.2017.09.019.
[35] Knoll, A.H., 2014. Paleobiological perspectives on early eukaryotic evolution. Cold Spring Harbor Perspectives in Biology, 6, a016121. https://cshperspectives.cshlp.org/content/6/10/a016121.full.pdf.
[36] Nagy, R.M., Porter, S.M., Dehler, C.M. y Shen, Y., 2009. Biotic turnover driven by eutrophication before the Sturtian low-latitude glaciation. Nature Geoscience, 2, 415-418. www.nature.com/articles/ngeo525.
[37] Fedonkin, 2003. Ver nota 8.
[38] Campbell, A.J., Waddington, E.D. y Warren, S.G., 2011. Refugium for surface life on Snowball Earth in a nearly‐enclosed sea? A first simple model for sea‐glacier invasion. Geophysical Research Letters, 38, L19502. https://agupubs.onlinelibrary.wiley.com/doi/epdf/10.1029/2011GL048846.
[39] Schrag, D.P. y Hoffman, P.F., 2001. Life, geology and snowball Earth. Nature, 409, 306. www.nature.com/articles/35053170.
[40] Bosak, T., Lahr, D.J.G., Pruss, S.B., Macdonald, F.A., Gooday, A.J., Dalton, L. y Matys, E.D., 2012. Possible early foraminiferans in post-Sturtian (716−635 Ma) cap carbonates. Geology, 40 (1), 67-70. https://doi.org/10.1130/G32535.1.
[41] Brocks, J.J., Jarrett, A.J.M., Sirantoine, E., Hallmann, C., Hoshino Y. y Liyanage, T., 2017. The rise of algae in Cryogenian oceans and the emergence of animals. Nature, 548, 578-581. www.nature.com/articles/nature23457.
[42] Bosak, T., Lahr, D.J.G., Pruss, S.B., Macdonald, F.A., Dalton, L. y Matys, E., 2011. Agglutinated Tests in post-Sturtian cap carbonates of Namibia and Mongolia. Earth and Planetary Science Letters, 308 (1-2), 29-40. https://doi.org/10.1016/j.epsl.2011.05.030.
[43] Moore, K.R., Bosak, T., Macdonald, F., Du, K., Newman, S.A., Lahr, D.J.G. y Pruss, S.B., 2017. Pyritized Cryogenian cyanobacterial fossils from arctic Alaska. Palaios, 32 (12), 769-778. https://doi.org/10.2110/palo.2017.063.
[44] Love, G.D. y otros, 2009. Fossil steroids record the appearance of Demospongiae during the Cryogenian period. Nature, 457, 718-721. www.nature.com/articles/nature07673. Maloof, A.C. y otros, 2010. Possible animal-body fossils in pre-Marinoan limestones from South Australia. Nature Geoscience, 3, 653-659. www.nature.com/articles/ngeo934. Gold, D.A., Grabenstatter, J., de Mendoza, A., Riesgo, A., Ruiz-Trillo, I. y Summons, R.E., 2016. Sterol and genomic analyses validate the sponge biomarker hypothesis. Proceedings of the National Academy of Sciences, 113 (10), 2684-2689. www.pnas.org/content/113/10/2684. Zumberge, J.A. y otros, 2018. Demosponge steroid biomarker 26-methylstigmastane provides evidence for Neoproterozoic animals. Nature Ecology & Evolution, 2, 1709-1714. www.nature.com/articles/s41559-018-0676-2.
[45] Van Maldegem, L.M. y otros, 2019. Bisnorgammacerane traces predatory pressure and the persistent rise of algal ecosystems after Snowball Earth. Nature Communications, 10, 476. www.nature.com/articles/s41467-019-08306-x.
[46] Brocks y otros, 2017. Ver nota 41.
[47] Sahoo, S.K. y otros, 2012. Ocean oxygenation in the wake of the Marinoan glaciation. Nature, 489, 546-549. www.nature.com/articles/nature11445.
[48] Hoffman y Schrag, 2002. Ver nota 16.
[49] McFadden, K.A., Huang, J., Chu, X., Jiang, G., Kaufman, A.J., Zhou, C., Yuan, X. y Xiao, S., 2008. Pulsed oxidation and biological evolution in the Ediacaran Doushantuo Formation. Proceedings of the National Academy of Sciences, 105 (9), 3197-3202. www.pnas.org/content/pnas/105/9/3197.full.pdf.
[50] Canfield, D.E., Poulton, S.W. y Narbonne, G.M., 2007. Late-Neoproterozoic deep-ocean oxygenation and the rise of animal life. Science, 315 (5808), 92-95. https://science.sciencemag.org/content/315/5808/92.
[51] Li, C., Love, G.D., Lyons, T.W., Fike, D.A., Sessions, A.L. y Chu, X., 2010. A stratified redox model for the Ediacaran ocean. Science, 328 (5974), 80-83. https://science.sciencemag.org/content/328/5974/80.
[52] Tostevin, R. y otros, 2016. Low-oxygen waters limited habitable space for early animals. Nature Communications, 7, 12818. www.nature.com/articles/ncomms12818.
[53] Vickers-Rich, P., 2007. Saline giants, cold cradles and global playgrounds of Neoproterozoic Earth: the origin of the Animalia. Geological Society of London, Special Publications, 286, 447-448. https://sp.lyellcollection.org/content/286/1/447.
[54] Planavsky, N.J., Rouxel, O.J., Bekker, A., Lalonde, S.V., Konhauser, K.O., Reinhard, C.T. y Lyons, T.W., 2010. The evolution of the marine phosphate reservoir. Nature, 467, 1088-1090. www.nature.com/articles/nature09485.
[55] Ver: https://es.wikipedia.org/wiki/Animalia.
[56] Dohrmann, M. y Wörheide, G., 2017. Dating early animal evolution using phylogenomic data. Scientific Reports, 7, 3599. www.nature.com/articles/s41598-017-03791-w. Lozano-Fernandez, J., dos Reis, M. Donoghue, P.C.J. y Pisani, D., 2017. RelTime rates collapse to a strict clock when estimating the timeline of animal diversification. Genome Biology and Evolution, 9 (5), 1320-1328. https://doi.org/10.1093/gbe/evx079.
[57] Gaiti, F., Jindrich, K., Fernandez-Valverde, S.L., Roper, K.E., Degnan, B.M. y Tanurdžić, M., 2017. Landscape of histone modifications in a sponge reveals the origin of animal cisregulatory complexity. eLife, 6, e22194. https://elifesciences.org/articles/22194.
[58] Simion, P. y otros, 2017. A large and consistent phylogenomic dataset supports sponges as the sister group to all other animals. Current Biology, 27 (7), R259-R261. https://doi.org/10.1016/j.cub.2017.02.031.
[59] Love y otros, 2009. Gold y otros, 2016. Zumberge y otros, 2018. Ver nota 44.
[60] Dunn, C.W. y otros, 2008. Broad phylogenomic sampling improves resolution of the animal tree of life. Nature, 452, 745-749. www.nature.com/articles/nature06614. Ryan, J.F. y otros, 2013. The genome of the ctenophore Mnemiopsis leidyi and Its implications for cell type evolution. Science, 342 (6164), 1242592. https://science.sciencemag.org/content/342/6164/1242592.abstract. Shen, X.-X., Hittinger, C.T. y Rokas, A., 2017. Contentious relationships in phylogenomic studies can be driven by a handful of genes. Nature Ecology & Evolution, 1, 0126. www.nature.com/articles/s41559-017-0126. Whelan, N.V., Kocot, K.M., Moroz, T.P., Mukherjee, K., Williams, P., Paulay, G., Moroz, L.L. y Halanych, K.M., 2017. Ctenophore relationships and their placement as the sister group to all other animals. Nature Ecology & Evolution, 1, 1737-1746. www.nature.com/articles/s41559-017-0331-3.
[61] Zhao, Y. y otros, 2019. Cambrian Sessile, Suspension Feeding Stem-Group Ctenophores and Evolution of the Comb Jelly Body Plan. Current Biology, 29 (7), P1112-1125.E2. https://doi.org/10.1016/j.cub.2019.02.036.
[62] Blackstone, N.W., 2009. A new look at some old animals. PLoS Biology, 7 (1), e1000007. https://doi.org/10.1371/journal.pbio.1000007. Ver también: https://es.wikipedia.org/wiki/Placozoa.
[63] Schierwater, B., Eitel, M., Jakob, W., Osigus, H.-J., Hadrys, H., Dellaporta, S.L., Kolokotronis, S.-O. y DeSalle, R., 2009. Concatenated analysis sheds light on early metazoan evolution and fuels a modern ‘‘Urmetazoon’’ hypothesis. PLoS Biology, 7 (1), e1000020. https://doi.org/10.1371/journal.pbio.1000020.
[64] Paps, J. y Holland, P.W.H., 2018. Reconstruction of the ancestral metazoan genome reveals an increase in genomic novelty. Nature Communications, 9, 1730. www.nature.com/articles/s41467-018-04136-5.
[65] Cohen, P.A., Strauss, J.V., Rooney, A.D., Sharma, M. y Tosca, N., 2017. Controlled hydroxyapatite biomineralization in an ~810 million-year-old unicellular eukaryote. Science Advances, 3 (6), e1700095. https://advances.sciencemag.org/content/advances/3/6/e1700095.full.pdf.
[66] Jenkins, R.J.F., 2007. ‘Ediacaran’ as a name for the newly designated terminal Proterozoic period. Geological Society, London, Special Publications, 286, 137-142. https://doi.org/10.1144/SP286.9.
[67] Evans, S.D., Dzaugis, P.W., Droser, M.L. y Gehling, J.G., 2018. You can get anything you want from Alice’s Restaurant Bed: exceptional preservation and an unusual fossil assemblage from a newly excavated bed (Ediacara Member, Nilpena, South Australia). Australian Journal of Earth Sciences. https://doi.org/10.1080/08120099.2018.1470110.
[68] Glaessner, M.F. y Wade, M., 1966. The late Precambrian fossils from Ediacara, South Australia. Palaeontology, 9 (4), 599-628. www.palass.org/sites/default/files/media/publications/palaeontology/volume_9/vol9_part4_pp599-628.pdf.
[69] Bobrovskiy, I., Krasnova, A., Ivantsov, A., Luzhnaya (Serezhnikova), E. y Brocks, J.J., 2019. Simple sediment rheology explains the Ediacara biota preservation. Nature Ecology & Evolution, 3, 582-589. www.nature.com/articles/s41559-019-0820-7.
[70] Cunningham, J.A., Vargas, K., Yin, Z., Bengtson, S. y Donoghue, P.C.J., 2017. The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. Journal of the Geological Society, 174 (5), 793-802. https://doi.org/10.1144/jgs2016-142.
[71] Ver: https://es.wikipedia.org/wiki/Yacimiento_de_Ediacara; https://es.wikipedia.org/wiki/Biota_del_periodo_Ediac%C3%A1rico.
[72] Canfield y otros, 2007. Ver nota 50.
[73] Shen, Y., Zhang, T. y Hoffman, P.F., 2008. On the coevolution of Ediacaran oceans and animals. Proceedings of the National Academy of Sciences, 105 (21), 7376-7381. www.pnas.org/content/pnas/105/21/7376.full.pdf.
[74] Shen, B., Dong, L., Xiao, S. y Kowalewski, M., 2008. The Avalon Explosion: Evolution of Ediacara morphospace. Science, 319 (5859), 81-84. https://science.sciencemag.org/content/sci/319/5859/81.full.pdf.
[75] McMenamin, M.A.S., 1986. The garden of Ediacara. Palaios, 1 (2), 178-182. www.jstor.org/stable/3514512.
[76] Seilacher, A., Grazhdankin, D. y Legouta, A., 2003. Ediacaran biota: The dawn of animal life in the shadow of giant protists. Paleontological Research, 7 (1), 43-54. https://doi.org/10.2517/prpsj.7.43.
[77] Rahman, I.A., Darroch, S.A.F., Racicot, R.A. y Laflamme, M., 2015. Suspension feeding in the enigmatic Ediacaran organism Tribrachidium demonstrates complexity of Neoproterozoic ecosystems. Scientific Advances, 1, e1500800. https://advances.sciencemag.org/content/advances/1/10/e1500800.full.pdf.
[78] Darroch, S.A.F., Laflamme, M. y Wagner, P.J., 2018. High ecological complexity in benthic Ediacaran communities. Nature Ecology & Evolution, 2, 1541-1547. www.nature.com/articles/s41559-018-0663-7.
[79] Ver: https://es.wikipedia.org/wiki/Rangeomorpha.
[80] Boag, T.H., Stockey, R.G., Elder, L.E., Hull, P.M. y Sperling, E.A., 2018. Oxygen, temperature and the deep-marine stenothermal cradle of Ediacaran evolution. Proceedings Royal Society B, 285, 20181724. http://dx.doi.org/10.1098/rspb.2018.1724.
[81] Laflamme, M., Xiao, S. y Kowalewski, M., 2009. Osmotrophy in modular Ediacara organisms. Proceedings of the National Academy of Sciences, 106 (34), 14438-14443. www.pnas.org/content/pnas/106/34/14438.full.pdf.
[82] Hoyal Cuthill, J.F. y Conway Morris, S., 2017. Nutrient-dependent growth underpinned the Ediacaran transition to large body size. Nature Ecology & Evolution, 1, 1201-1204. www.nature.com/articles/s41559-017-0222-7.
[83] Mitchell, E.G., Kenchington, C.G., Liu, A.G., Matthews, J.J. y Butterfield, N.J., 2015. Reconstructing the reproductive mode of an Ediacaran macro-organism. Nature, 524, 343-346. www.nature.com/articles/nature14646.epdf.
[84] Glaessner y Wade, 1966. Ver nota 68. Ver también: https://es.wikipedia.org/wiki/Kimberella.
[85] Droser, M.L. y Gehling, J.G., 2008. Synchronous aggregate growth in an abundant new Ediacaran tubular organism. Science, 319 (5870), 1660-1662. https://science.sciencemag.org/content/319/5870/1660. Joel, L.V., Droser, M.L. y Gehling, J.G., 2014. A new enigmatic, tubular organism from the Ediacara Member, Rawnsley Quartzite, South Australia. Journal of Paleontology, 88 (2), 253-262. https://doi.org/10.1666/13-058.
[86] Pehr, K., Love, G.D., Kuznetsov, A., Podkovyrov, V., Junium, C.K., Shumlyanskyy, L., Sokur, T. y Bekker, A., 2018. Ediacara biota flourished in oligotrophic and bacterially dominated marine environments across Baltica. Nature Communications, 9, 1807. www.nature.com/articles/s41467-018-04195-8.pdf.
[87] Budd, G.E. y Jensen, S., 2015. The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution. Biological Reviews, 92 (1), 446-473. https://doi.org/10.1111/brv.12239.
[88] Hoekzema, R.S., Brasier, M.D., Dunn, F.S. y Liu, A.G., 2017. Quantitative study of developmental biology confirms Dickinsonia as a metazoan. Proceedings Royal Society B, 284, 20171348. http://dx.doi.org/10.1098/rspb.2017.1348.
[89] Bobrovskiy, I., Hope, J.M., Ivantsov, A., Nettersheim, B.J., Hallmann, C. y Brocks, J.J., 2018. Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. Science, 361 (6408), 1246-1249. https://science.sciencemag.org/content/361/6408/1246.
[90] Retallack, G.J., 2013. Ediacaran life on land. Nature, 493, 89-92. www.nature.com/articles/nature11777. Xiao, S. y Knauth, L.P., 2013. Fossils come in to land. Nature, 493, 28-29. www.nature.com/articles/nature11765. Retallack, G.J., 2018. Interflag sandstone laminae, a novel sedimentary structure, with implications for Ediacaran paleoenvironments. Sedimentary Geology, 379, 60-76. https://doi.org/10.1016/j.sedgeo.2018.11.003.
[91] Evans, S.D., Droser, M.L. y Gehling, J.G., 2017. Highly regulated growth and development of the Ediacara macrofossil Dickinsonia costata. PLoS ONE, 12 (5), e0176874. https://doi.org/10.1371/journal.pone.0176874.
[92] Evans, S.D., Gehling, J.G. y Droser, M.L., 2019. Slime travelers: Early evidence of animal mobility and feeding in an organic mat world. Geobiology, en imprenta. https://doi.org/10.1111/gbi.12351.
[93] Chen, L., Xiao, S., Pang, K., Zhou, C. y Yuan, X., 2014. Cell differentiation and germ–soma separation in Ediacaran animal embryo-like fossils. Nature, 516, 238-241. www.nature.com/articles/nature13766. Xiao, S., Muscente, A.D., Chen, L., Zhou, C., Schiffbauer, J.D., Wood, A.D., Polys, N.F. y Yuan, X., 2014. The Weng’an biota and the Ediacaran radiation of multicellular eukaryotes. National Science Review, 1 (4), 498-520. https://doi.org/10.1093/nsr/nwu061. Anderson, R.P., Macdonald, F.A., Jones, D.S., McMahon, S. y Briggs, D.E.G., 2017. Doushantuo-type microfossils from latest Ediacaran phosphorites of northern Mongolia. Geology, 45 (12), 1079-1082. https://doi.org/10.1130/G39576.1.
[94] Huldtgren, T., Cunningham, J.A., Yin, C., Stampanoni, M., Marone, F., Donoghue, P.C.J. y Bengtson, S., 2011. Fossilized nuclei and germination structures identify Ediacaran “animal embryos” as encysting protists. Science, 334 (6063), 1696-1699. https://science.sciencemag.org/content/334/6063/1696.abstract.
[95] Cunningham, J.A. y otros, 2012. Experimental taphonomy of giant sulphur bacteria: implications for the interpretation of the embryo-like Ediacaran Doushantuo fossils. Proceedings Royal Society B, 279, 1857-1864. https://doi.org/10.1098/rspb.2011.2064.
[96] Seilacher y otros, 2003. Ver nota 76.
[97] Darroch, S.A.F., Rahman, I.A., Gibson, B., Racicot, R.A. y Laflamme, M., 2017. Inference of facultative mobility in the enigmatic Ediacaran organism Parvancorina. Biology Letters, 13 (5). https://doi.org/10.1098/rsbl.2017.0033.
[98] Gibson, B.M., Rahman, I.A., Maloney, K.M., Racicot, R.A., Mocke, H., Laflamme, M. y Darroch, S.A.F., 2019. Gregarious suspension feeding in a modular Ediacaran organism. Science Advances, 5 (6), eaaw0260. https://advances.sciencemag.org/content/5/6/eaaw0260.
[99] Mitchell, E.G. y Kenchington, C.G., 2018. The utility of height for the Ediacaran organisms of Mistaken Point. Nature Ecology & Evolution, 2, 1218-1222. www.nature.com/articles/s41559-018-0591-6.
[100] Dornbos, S.Q., Oji, T., Kanayama, A. y Gonchigdorj, S., 2016. A new Burgess Shale-type deposit from the Ediacaran of western Mongolia. Scientific Reports, 6, 23438. www.nature.com/articles/srep23438.
[101] Bobrovskiy, I., Hope, J.M., Krasnova, A., Ivantsov, A. y Brocks, J.J., 2018. Molecular fossils from organically preserved Ediacara biota reveal cyanobacterial origin for Beltanelliformis. Nature Ecology & Evolution, 2, 437-440. www.nature.com/articles/s41559-017-0438-6.
[102] Seilacher y otros, 2003. Ver nota 76.
[103] Seilacher, A. y Pflüger, F., 1994. From biomats to benthic agriculture: a biohistoric evolution. Citado en: Oji y otros, 2018. Ver nota 107.
[104] Seilacher y otros, 2003. Ver nota 76.
[105] Chen, Z., Chen, X., Zhou, C., Yuan, X. y Xiao, S., 2018. Late Ediacaran trackways produced by bilaterian animals with paired appendages. Science Advances, 4, eaao6691. http://advances.sciencemag.org/content/advances/4/6/eaao6691.full.pdf.
[106] Mariotti, G., Pruss, S.B., Ai, X., Perron, J.T. y Bosak, T., 2016. Microbial Origin of Early Animal Trace Fossils? Journal of Sedimentary Research, 86 (4), 287-293. https://doi.org/10.2110/jsr.2016.19.
[107] Oji, T., Dornbos, S.Q., Yada, K., Hasegawa, H., Gonchigdorj, S., Mochizuki, T., Takayanagi, H. e Iryu, Y., 2018. Penetrative trace fossils from the late Ediacaran of Mongolia: early onset of the agronomic revolution. Royal Society open science, 5, 172250. http://dx.doi.org/10.1098/rsos.172250.
[108] Parry, L.A. y otros, 2017. Ichnological evidence for meiofaunal bilaterians from the terminal Ediacaran and earliest Cambrian of Brazil. Nature Ecology & Evolution, 1, 1455-1464. www.nature.com/articles/s41559-017-0301-9.
[109] Budd y Jensen, 2015. Ver nota 87.
[110] Zhuravlev, A.Y., Wood, R.A. y Penny, A.M., 2015. Ediacaran skeletal metazoan interpreted as a lophophorate. Proceedings Royal Society B, 282, 20151860. http://dx.doi.org/10.1098/rspb.2015.1860.
[111] Wood, R.A., Zhuravlev, A.Y., Sukhov, S.S., Zhu, M. y Zhao, F., 2017. Demise of Ediacaran dolomitic seas marks widespread biomineralization on the Siberian Platform. Geology, 45 (1), 27-30. https://doi.org/10.1130/G38367.1.
[112] Ver: https://es.wikipedia.org/wiki/Explosi%C3%B3n_c%C3%A1mbrica.
[113] Hoyal Cuthill, J.F. y Han, J., 2018. Cambrian petalonamid Stromatoveris phylogenetically links Ediacaran biota to later animals. Palaeontology, 61 (6), 813-823. https://onlinelibrary.wiley.com/doi/full/10.1111/pala.12393.
[114] Zhu, M., Zhuravlev, A.Y., Wood, R.A., Zhao, F. y Sukhov, S.S., 2017. A deep root for the Cambrian explosion: Implications of new bio- and chemostratigraphy from the Siberian Platform. Geology, 45 (5), 459-462. https://doi.org/10.1130/G38865.1. Wood, R.A., 2019. The rise of animals. Scientific American, junio 2019, 18-25. www.ScientificAmerican.com.

Un comentario en “Los albores de la vida (7): La llegada de los animales”