Proterozoico
La larga historia de la tierra, de unos 4500 millones de años, se deja subdividir en tres fases: una inicial, que comprende el eón Hádico y el Arcaico, y ocupa casi la primera mitad de la existencia de nuestro planeta, en la que se formaron los primeros continentes y apareció la vida; una segunda fase, intermedia, tan larga como la primera, llamada el Proterozoico; y una tercera fase, el Fanerozoico, que ocupa poco más del diez por ciento de los años del planeta, pero que es la fase en la que ocurrió mucha acción: la explosión de la vida, con la aparición de animales en los mares, la tierra y los cielos, plantas y árboles, y al final, unos bípedos del género Homo. Pero, ¿qué pasó entonces en el Proterozoico? Si ya había una multitud de organismos en el Arcaico, ¿por qué tardó la vida 2000 millones de años en desarrollar formas complejas? ¿Habría sido el Proterozoico como la Edad Media en la historia de Europa, que a primera vista parece ser una época oscura entre dos fases de auge e innovación, durante la que habría pasado poco de relevancia? ¿O estaríamos equivocados al pensar así?
El Proterozoico, cuyo nombre significa “primera vida”, fue el eón más largo de la historia de la tierra: empezó hace 2500, y terminó hace 541 millones de años [i] (ver línea de tiempo). Es fácil decir que este eón duró casi 2000 millones de años – pero imaginarse esta enormidad de tiempo es difícil. Sí ocurrieron acontecimientos importantes en la historia de nuestro planeta, pero éstos están separados entre si por largos intervalos de cientos de millones de años en los que poco pareciera haber pasado.
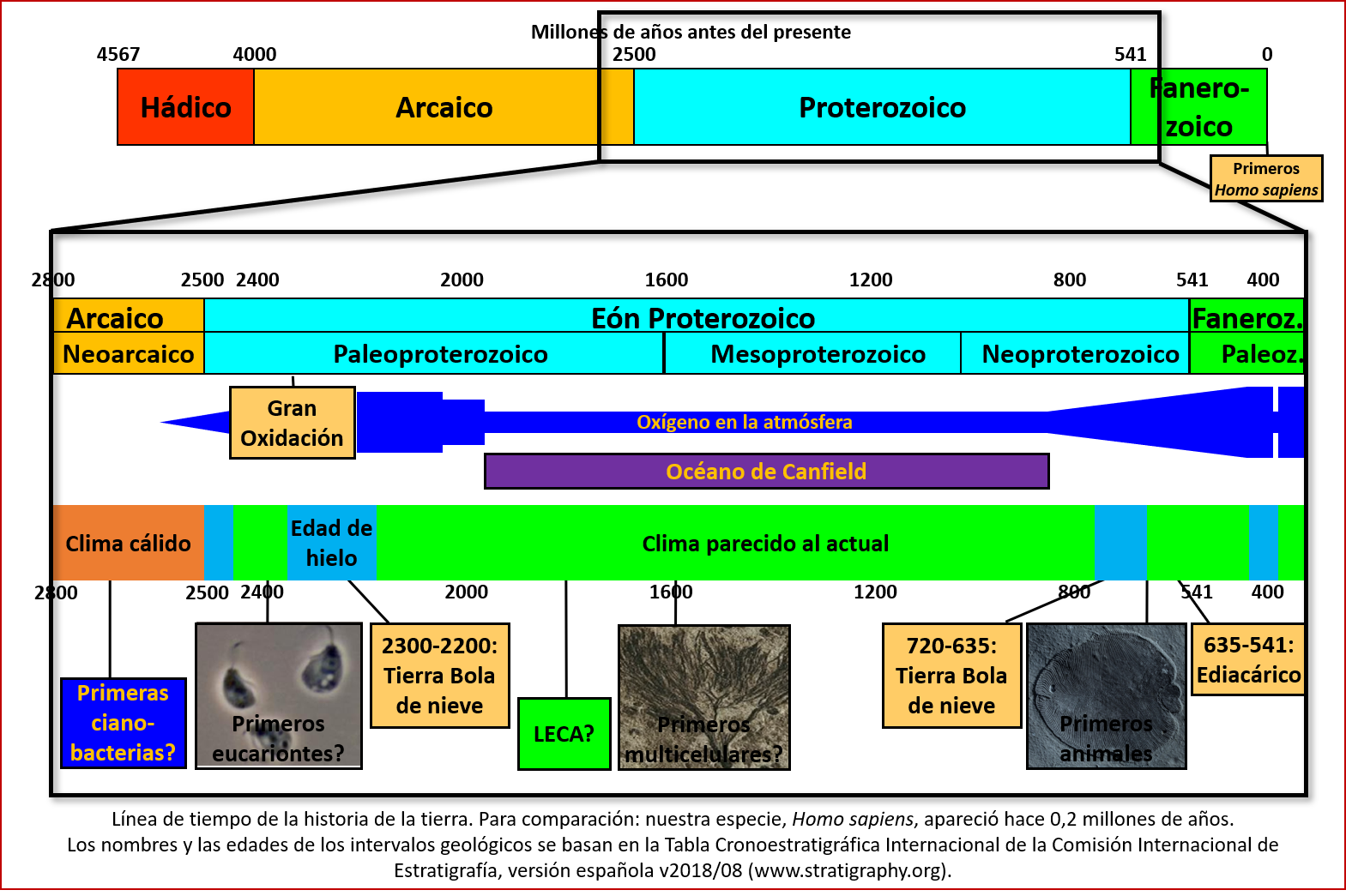
El Proterozoico arrancó con un acontecimiento importante, la Gran Oxidación, de la que hablamos en la entrega anterior: el primer aumento importante en la cantidad de oxígeno en la atmósfera. Este aumento iba de la mano de la aparición de la fotosíntesis (el mecanismo que tienen los organismos de convertir la luz del sol en energía) y de una fase de épocas de hielo. Asimismo ocurrió, al fin del eón, la segunda gran fase de aumento del oxígeno, y otra fase de épocas de hielo.
Entre los acontecimientos del Proterozoico, algunos de los más relevantes tienen que ver con el desarrollo de la vida terrestre. Al inicio del Proterozoico aparecieron las primeras células eucariotas, es decir, con un núcleo. Más tarde se desarrollaron los primeros organismos multicelulares. Y, ya a finales de este eón, surgieron los animales, o sea, los primeros organismos capaces de moverse por su propia fuerza.
Hablemos, pues, de estos cambios en la vida y en entorno terrestre.
Los eucariontes
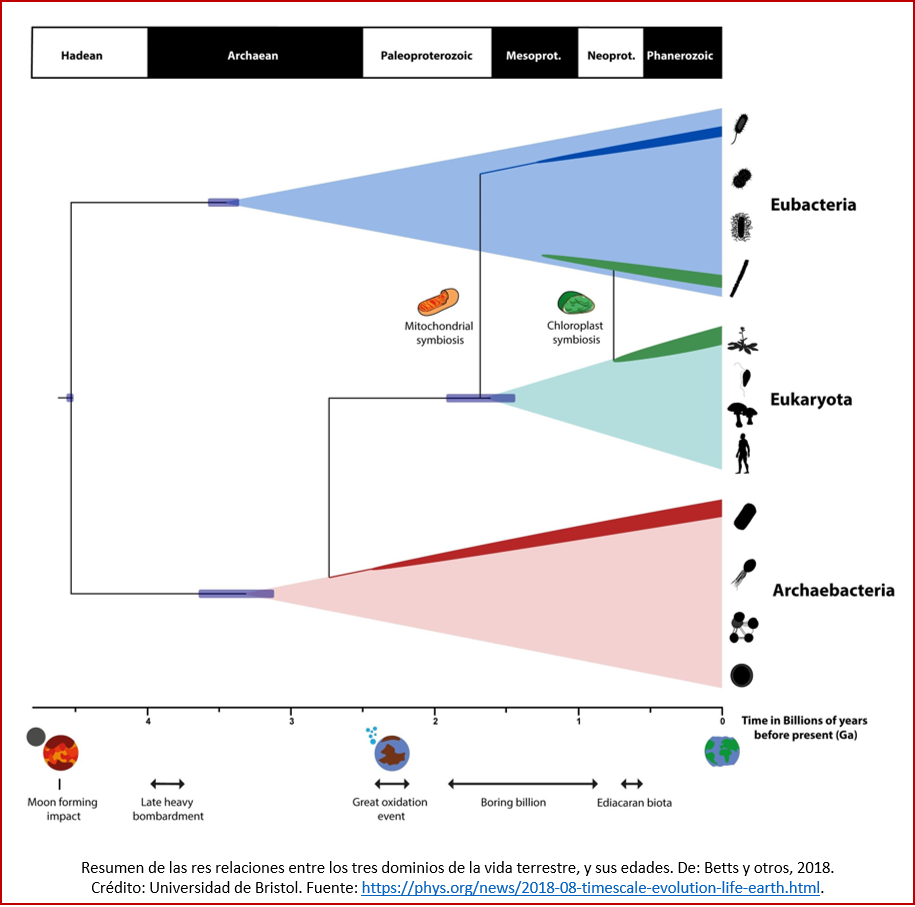
Los eucariontes son aquellos organismos cuyas células tienen un núcleo, contentivo del material genético [ii]. Conforman el dominio de la vida llamado Eukarya (los otros dos dominios son Archaea y Bacteria, cuyas células no tienen núcleo y que por tanto se denominan procariontes; ver la imagen). Dentro de los eucariontes se encuentran los reinos de los animales, las plantas y los hongos (así como el reino de los protistas, que engloba una variedad de organismos que no caen en ninguno de los otros tres reinos, tales como los mohos y las amebas).
El dominio Eukarya está relacionado con el dominio Archaea desde el punto de vista del ADN nuclear y de la maquinaria genética, y en efecto, los dos grupos han sido clasificados juntos por el biólogo anglocanadiense Thomas Cavalier-Smith, en el clado Neomura [iii]. Desde otros puntos de vista, tales como la composición de la membrana, se asemeja más al dominio Bacteria. Mientras que el núcleo celular tiene elementos genéticos relacionados con las arqueas, las mitocondrias y la membrana celular tienen características bacterianas. Para explicar esta mezcla de características se ha propuesto una variedad de hipótesis, pero cada vez son mayores las evidencias que indican que en su origen, los eucariontes son el producto de la fusión de una arquea con componentes bacterianos [iv]. La fusión genética es más evidente al constatar que los genes informativos parecen tener un origen arqueano y los genes operacionales un origen bacteriano [v].
El origen simbiótico de varios elementos de la célula eucariota fue postulado por primera vez por la bióloga estadounidense Lynn Margulis (1938-2011) [vi]. Esta hipótesis, inicialmente muy controvertida [vii], ganó aceptación lentamente, y ahora es una teoría aceptada y corroborada [viii].
En comparación con las células procariotas, las células eucariotas son mucho más grandes y contienen más compartimentos (ver la imagen). En primer lugar, se encuentra el núcleo, el cual contiene el material genético. Además, hay que destacar las mitocondrias y, en el caso de las plantas, los cloroplastos.
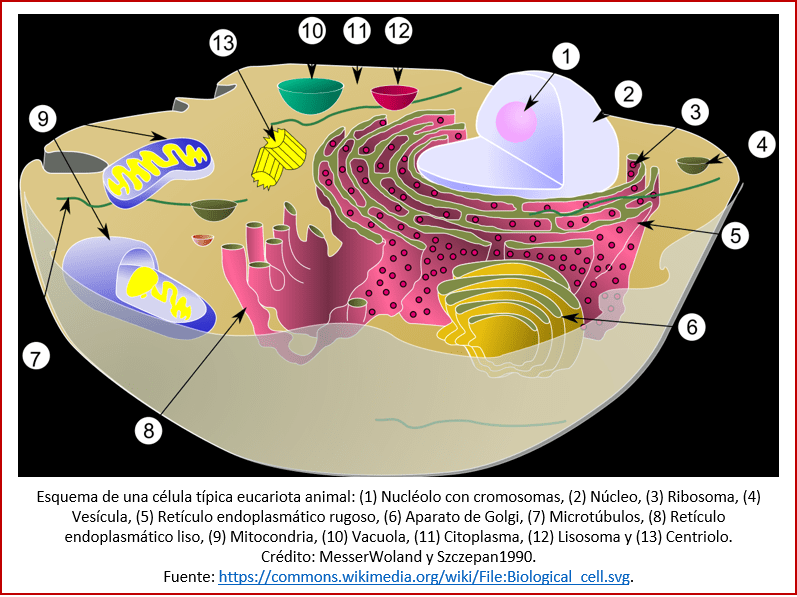
La mitocondria, ahora un orgánulo de la célula eucariota, originalmente era una bacteria independiente. En efecto, hasta el día de hoy la mitocondria tiene su propio material genético, que es transmitido de una generación a otra (por la línea materna) [ix]. Inicialmente se pensó que la mitocondria provenía de una bacteria aeróbica, pero después se determinó se originó en un organismo anaeróbico, más viejo, donde la mitocondria original llevaba a cabo la fotosíntesis [x]. Durante mucho tiempo se consideró que ésta era un procarionte gramnegativo (que, tal vez, a su vez fue el producto de una endosimbiosis [xi]); sin embargo, recientemente se ha postulado que el ancestro de la mitocondria fue una proteobacteria procedente de un linaje antiguo, ahora desaparecido [xii]. Sea como fuere, la capacidad que nosotros, los humanos, así como los demás animales, tenemos para aprovechar el oxígeno en la atmósfera, la debemos a los vestigios de bacterias arcaicas en nuestras células [xiii].
La aparición de los eucariontes coincidió con la absorción de esta bacteria por una célula eucaria ancestral; en lugar de ser digerida y destruida, la bacteria se quedó con vida dentro de la célula eucaria, como un endosimbionte. La mitocondria permitió al eucariota ancestral la respiración aeróbica y con ello, ayudó al mecanismo preexistente en la célula a aprovechar al máximo la energía contenida en la materia orgánica [xiv]. Por tanto, se supone que los eucariontes son aeróbicos desde su aparición; los pocos eucariontes anaeróbicos se desarrollaron a partir de ancestros aeróbicos [xv]. En comparación con muchas proteínas típicas de los eucariontes, las mitocondrias entraron tarde en la célula pre-eucariota, así que se pudiera decir que fue sólo al adquirir las mitocondrias que apareció la célula eucariota [xvi].
Para entender la relevancia de esta capacidad que tenían los eucariontes, de maximizar la energía obtenida de sus alimentos, es preciso considerar que el ambiente acuático en el que vivían estos organismos se estaba haciendo menos rico en metales y otros elementos importantes para el metabolismo de los organismos, debido al aumento del oxígeno en la atmósfera que causaba la fijación de estos elementos en minerales en los continentes. Visto de esta manera, la aparición de los eucariontes, su tendencia de alimentarse de otros organismos o de sus restos, y el posterior desarrollo de la multicelularidad, se pueden considerar una respuesta de la vida al empobrecimiento del ambiente en cuanto a elementos críticos para la vida [xvii].
Los cloroplastos, que permiten al organismo (por lo general, una planta) realizar la fotosíntesis, también eran originalmente simbiontes, en este caso provenientes de una cianobacteria que fue incorporada a un organismo eucarionte. A diferencia de las mitocondrias, esta cianobacteria perdió – así como ocurrió con todos los demás simbiontes – su material genético, el cual fue incorporado en el ADN nuclear del organismo [xviii].
Las mitocondrias y los cloroplastos son algunos de los reflejos de una capacidad característica de los eucariontes: la de asociarse con, o asimilar a, otros organismos. Tal como nosotros, los humanos, tenemos dentro de nuestros cuerpos, y sobre nuestra piel, una cantidad inimaginable de organismos variando desde bacterias hasta organismos complejos tales como la tenia, los primeros eucariontes ya vivían en simbiosis con bacterias y arqueas. Aparte de las mitocondrias y los cloroplastos, se puede mencionar simbiontes que ayudan en el metabolismo del organismo o en su desarrollo, o que influyen en su comportamiento [xix]. Algunos simbiontes llevan tanto tiempo fusionados con las células eucariontes que es difícil reconocerlos como tal; hay material genético en los eucariontes que puede provenir de simbiontes, pero no podemos estar seguros al respecto [xx].
En cuanto al núcleo se refiere: una de las características de las células eucariontes es que el material genético se encuentra en una parte específica de la célula (el núcleo), mientras que la traducción de las instrucciones genéticas a proteínas se realiza en otra parte. En los procariontes todo suele realizarse en el mismo lugar de la célula. Sin embargo, se ha encontrado bacterias que muestran una situación intermedia: cierta separación del lugar donde está el material genético del resto de la célula, donde se traducen las instrucciones genéticas [xxi].
Otra propiedad característica de la gran mayoría de los eucariontes es que, a diferencia de los procariontes, se reproducen sexualmente. Por la universalidad de la reproducción sexual entre los eucariontes, se supone que el último ancestro común de Eukarya ya se reproducía sexualmente. Como consecuencia, los eucariontes son los que más han experimentado la aparición de nuevas especies y, por ende, evolución [xxii].
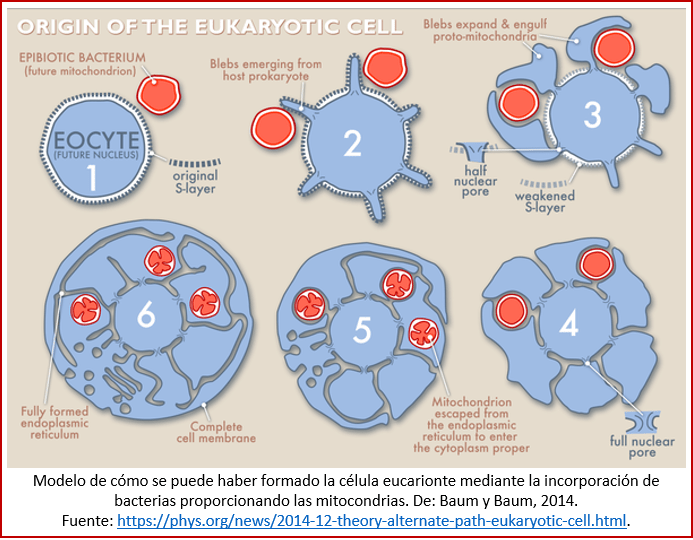
LECA: el último eucarionte común
Que sepamos, los eucariontes aparecieron una sola vez, debido a una hibridación fortuita entre dos organismos procariotas. Desconocemos cómo ocurrió esto, y si hubo pasos intermedios que condujeron a la aparición del primer eucarionte a partir de los procariontes [xxiii]. Un posible mecanismo para la incorporación de una bacteria con mitocondrias por parte de una arquea, es mediante la encapsulación de la bacteria por la membrana de la arquea (ver imagen, arriba) [xxiv]. Se ha postulado que, debido a la manera que los procariontes respiran a través de sus membranas celulares, es extremadamente improbable desde el punto de vista energético que una hibridación de este tipo pueda volver a darse [xxv].

El último ancestro común de todos los eucariontes actuales se denomina LECA (last eucaryotic common ancestor). Es el organismo del que descendieron todos los eucariontes que habitan hoy en día nuestro planeta (ver imagen). Es en gran medida hipotético, ya que no tenemos ninguna información directa acerca del LECA, pero se ha podido obtener una idea acerca de cómo era a partir de reconstrucciones filogenómicas (o sea, del árbol genealógico) de organismos actuales y fósiles. Así se pudo determinar que el LECA era capaz de moverse [xxvi], y que perteneció a un grupo de organismos unicelulares acuáticos que tienen dos flagelos (similares al látigo que hoy en día todavía tienen los espermatozoides) para propulsarse en el agua, parecido al actual Malawimonas (ver imagen, abajo) [xxvii].
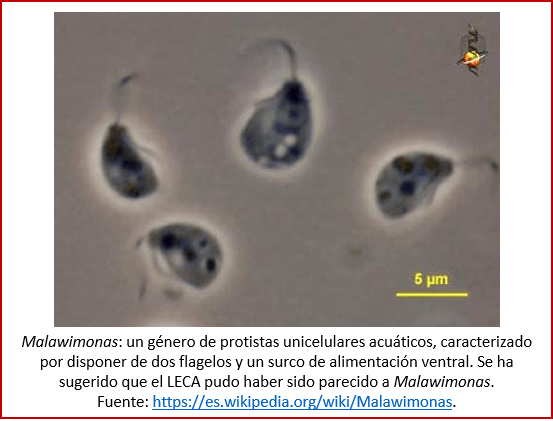
Cabe destacar que el LECA no fue necesariamente el primer eucarionte: probablemente hubo eucariontes antes de LECA, pero todos los grupos de eucariontes conocidos hoy en día se originaron a partir del LECA [xxviii]. El LECA es el organismo cuyos descendientes inmediatos dieron origen a los distintos reinos que arriba ya mencionamos, mediante una bifurcación: probablemente, una rama condujo hacia los animales, hongos, las amebas y otros, mientras que otra rama condujo hacia las plantas, las algas y varios grupos más [xxix].
Se pudo determinar también que el LECA estaba relacionado a las arqueas, pero algunos componentes de su célula (por ejemplo, las mitocondrias) tienen un origen bacteriano, lo que indica una fusión de una arquea con una bacteria (una alfa-proteobacteria), a la que ya hicimos referencia arriba. Es posible que la arquea ya tenía ciertas características de los eucariontes, tales como la capacidad de absorber otros organismos sin destruirlos [xxx]. Inicialmente se consideró que esta arquea perteneció a un súper-filo denominado TACK [xxxi], pero más recientemente se identificó otro súper-filo, denominado Asgard, caracterizado por tener varios genes que anteriormente se creían eran específicos de los eucariontes [xxxii]. Dentro de este súper-filo, se ha identificado un organismo, denominado Lokiarchaeum, que tiene proteínas parecidas a las de los eucariontes, y que por tanto pudiera pertenecer al linaje que dio origen a los eucariontes, en un proceso que fue tal vez más bien gradual [xxxiii].
Otros cambios genéticos relevantes incluyen la aparición, en los primeros eucariontes, de un gen que codifica para la generación de las proteína-quinasas, que es un grupo de enzimas que permiten que varias partes de la célula eucariota se comunican. Sin estas enzimas, el desarrollo de la célula eucariota no hubiera sido posible [xxxiv].
También puede haber sido crítica la capacidad que desarrollaron los eucariontes, mas no las bacterias, de neutralizar los “genes saltarines” o retrotransposones [xxxv], que pueden desactivar el funcionamiento de genes críticos para el organismo; mediante esta capacidad de los eucariontes, muchos de estos genes saltarines no sólo quedaron neutralizados, sino que además fueron utilizados para la creación de nuevos genes, que pudieron ayudar en la evolución de los organismos [xxxvi].
Con base en reconstrucciones genéticas y utilizando un “reloj molecular” (que calcula cuándo vivió el ancestro común de dos especies a partir de cuán diferentes son sus genomas, y cuya precisión ha ido mejorando aunque sigue dependiendo de muchas suposiciones [xxxvii]), se ha estimado que el LECA puede haber vivido hace unos 1800 millones de años. Ya hubo eucariontes antes, pero la gran radiación que dio origen a todos los eucariontes actuales ocurrió sólo en ese momento [xxxviii]. Las mitocondrias pudieron haberse incorporado a los eucariontes antes: según el reloj molecular, la fecha más antigua para este acontecimiento es de hace 2053 millones de años [xxxix] (ver imagen, al inicio de la entrada).
Los primeros eucariontes
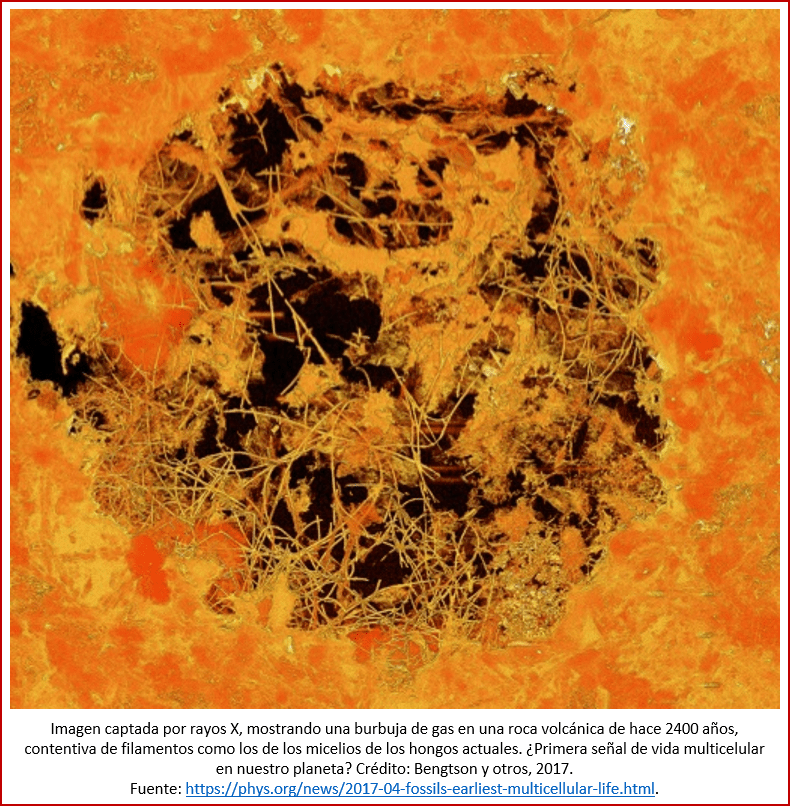
Los primeros eucariontes, probablemente algas, vivieron al inicio del Proterozoico, pero se desconoce cuándo exactamente. La posible alga Grypania vivió hace 1850 millones de años [xl]. Estructuras centimétricas de distintas formas, tanto circulares como alargadas, encontradas en rocas en Gabón con una edad de 2100 millones de años, han sido interpretadas como los restos de un organismo colonial o inclusive multicelular, presumiblemente eucariota y posiblemente capaz de moverse [xli]. Más viejos son los restos de lo que parecen ser hongos de hace 2200 millones de años [xlii], y 2400 millones de años (ver imagen) [xliii], ambos encontrados en rocas de Sudáfrica. Biomarcadores (moléculas orgánicas formadas por procesos biológicos) sugieren que los eucariontes, o por lo menos sus ancestros directos, existieron inclusive mucho antes: la presencia de esteranos en rocas de hace 2700 millones de años en Australia apunta a la presencia de eucariontes aeróbicos [xliv], pero existen dudas serias al respecto [xlv]. Pero, al aplicar el “reloj molecular” a los esteranos, se determinó que estos son más jóvenes: su aparición coincidió, de manera fortuita o no, con la Gran Oxidación, hace 2300 millones de años [xlvi]. También se reportaron microfósiles tubulares de hace 2700 millones de años, parecidos a los de algas modernas eucariotas, que pudieran indicar la existencia de eucariontes ya en aquel tiempo remoto [xlvii]. Sin embargo, los fósiles más tempranos que a veces se asignan a eucariotas son difíciles de interpretar y podrían pertenecer en realidad a bacterias [xlviii].
Fósiles no tan antiguos pero que pueden ser asignados con más seguridad a Eukarya, incluyen a unos acritarcos (probablemente quistes del eucarionte Tappania plana) de hace 1630 millones de años [xlix]; así como las células complejas bien preservadas de esta Tappania plana, de la misma edad, al parecer un hongo [l] que posiblemente se reproducía sexualmente [li]. También son claramente eucariontes los filamentos de algas rojas, mostrando estructuras celulares, que fueron encontrados en rocas de la India con una edad de 1600 millones de años [lii].
Después de LECA continuaron las fusiones, dando origen a – entre otras cosas – los cloroplastos, responsables de la fotosíntesis [liii]. Esta capacidad de fusionarse con otros organismos es lo que ha sido definido por algunos autores como una característica fundamental de los eucariontes (aunque otros prefieren ser más exactos, y definir los eucariontes a partir de la fusión con la bacteria que pasó a ser la mitocondria) [liv]. Por otro lado, no toda la evolución de los eucariontes se debe explicar como la consecuencia de fusiones [lv].
Mientras que las mitocondrias estaban probablemente incorporadas en los eucariontes desde la aparición de Eukarya, los cloroplastos tal vez se incorporaron posteriormente. Estimaciones de cuándo ocurrió esta incorporación arrojan edades variables, de entre 2100 y 1200 millones de años [lvi].
La primera radiación (o sea, diversificación) de los eucariontes de hace unos 1800 millones de años parece coincidir con un importante aumento en la cantidad de metales – zinc, cobre, molibdeno – que, aunque fuera en cantidades pequeñas, son indispensables para los organismos eucariontes. Este aumento se dio debido a la aparición de grandes cantidades de granito en los continentes y su posterior erosión, que liberaba estos metales. De tal manera, es posible que los procesos geológicos hicieron posible la evolución de la vida en nuestro planeta [lvii].
La aparición de la célula eucariota representa un salto cuántico en la historia de la vida, puesto que ésta es mucho más compleja que las células procariotas, de las arqueas y las bacterias, que existían antes, en una multitud de aspectos: forma y organización de la célula, cantidad de orgánulos dentro de la célula, la presencia de simbiontes, ecología, etcétera. Todas las células complejas son eucariotas, y prácticamente todos los organismos multicelulares son compuestos por células eucariotas [lviii].
Multicelularidad
Si la aparición de los primeros eucariontes fue un gran paso adelante en el desarrollo de la vida terrestre, no fue suficiente para que se formara vida compleja. Para eso, debió ocurrir un segundo paso: la aparición de los organismos multicelulares. Mientras que los eucariontes se desarrollaron una sola vez, la multicelularidad apareció, de manera independiente, unas cuantas veces. Si definimos un organismo multicelular como un agregado de células que están conectadas de manera permanente, que se comunican y cooperan, se puede afirmar que la multicelularidad apareció múltiples veces en las bacterias, unas seis veces en las algas, tres veces en los hongos, y una vez en los animales [lix]. Pero, ¿qué hizo que organismos individuales se juntaron con otros, perdiendo parte de su individualidad y comprometiendo su capacidad de tener descendientes propios?
Al parecer, una fase intermedia fue la de las colonias de organismos unicelulares, en las que los organismos tenían más éxito en términos de supervivencia y número de descendientes que si estuvieran solos. Por ejemplo, hay grupos de microbios que producen algún compuesto que beneficia a todo el grupo. Un organismo que forma agregaciones de células, es la levadura Saccharomyces cerevisiae, que ha sido utilizada para muchos estudios. Entre otras cosas, se determinó que las agregaciones se forman cuando, al multiplicarse, las células se mantienen pegadas. Esto hace que las enzimas producidas por las células sean compartidas y aprovechadas mejor, y así también se puede evitar la aparición de aprovechadores. Estas agrupaciones son capaces de seguir creciendo en entornos con escasos alimentos, algo del que no son capaces los organismos individuales [lx].
En las colonias siempre hay organismos que se benefician de los compuestos producidos por la colonia sin que trabajen para producirlo: los aprovechados. Colonias con un porcentaje alto de aprovechados colapsarán. Sin embargo, un porcentaje bajo de aprovechados no sólo es manejable, sino que – según se demostró en experimentos – su presencia puede ser provechosa para el conjunto del organismo, para la adaptación del mismo a cambios en su entorno [lxi].
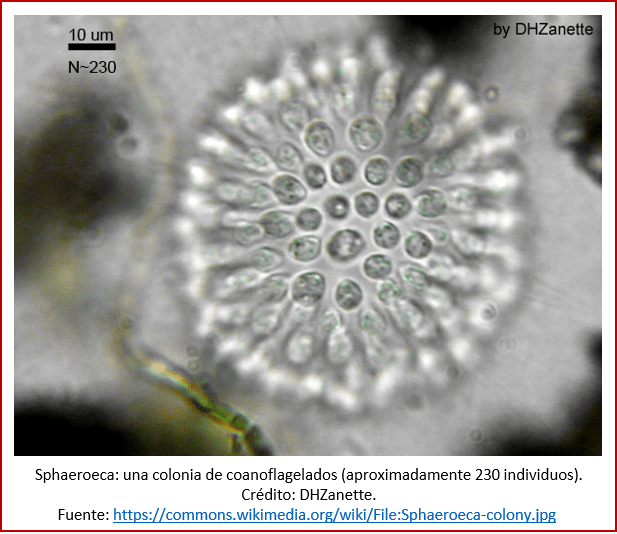
Las colonias pueden formarse según la necesidad, y disolverse cuando sea preciso; esto se ha observado en el caso de los coanoflagelados, algas que pueden vivir tanto de manera solitaria como en colonias (ver imagen), y que son el grupo más cercano a los animales [lxii]. Pero en el siguiente paso de la transición a la multicelularidad, los miembros de la colonia empiezan a tener funciones distintas y empieza a haber una interdependencia entre las distintas partes del grupo: el grupo en su totalidad empieza a estar en un nivel superior al de los componentes individuales, y puede ser considerado ya prácticamente como un organismo en su propio derecho: un organismo multicelular.
El cambio de organismos unicelulares en una colonia, a un organismo multicelular ha sido comparado con un trinquete: un engranaje que sólo puede girar en un sentido (hacia mayor cooperación), no hacia atrás [lxiii]. El momento clave en este cambio parece ser cuando resulta ser más provechoso para una célula en el grupo, dejar que otras células realicen ciertas tareas (por ejemplo, producir ciertos compuestos) que ponerse ella misma a realizarlas [lxiv]. La resultante división del trabajo tiene ventajas para todos, y ocurre con bastante facilidad, con tal que las células tengan suficiente plasticidad para cambiar [lxv]. Factores que contribuyen a que se dé una división del trabajo, incluyen: si la posición de una célula dentro de la colonia la predispone a realizar cierta tarea, si el rendimiento de la colonia mejora lo suficiente si hay división de labores, y si hay suficiente sinergia entre módulos realizando distintas funciones [lxvi]. En experimentos de laboratorio se pudo recrear la evolución de un organismo unicelular en uno multicelular, en el que, cuando se dio una separación del trabajo, las células inicialmente se mantuvieron iguales, pero después aparecieron células específicas para la tarea que tenían [lxvii].
Desde un punto de vista molecular, se ha identificado varios compuestos importantes para alcanzar o mantener la multicelularidad. Los coanoflagelados se agrupan para formar colonias en respuesta a la presencia de una sustancia producida por bacterias [lxviii]. El alga unicelular Chlamydomonas se vuelve colonial cuando se expresa en el ADN un regulador del ciclo de la célula [lxix]. Un dominio de interacciones de proteínas, GKPID, se desarrolló para facilitar la conexión física entre las células del organismo [lxx]. En general, organismos multicelulares parecen modificar proteínas existentes del tiempo que eran unicelulares, en lugar de crear proteínas nuevas [lxxi].
¿Qué ventaja tenía la multicelularidad? Si el paso a la multicelularidad se ha dado en múltiples ocasiones, y en todos los tres dominios de la vida, ésta debe conllevar claros beneficios para el organismo, suficientes para que los organismos unicelulares estén dispuestos a cambiar su individualidad por un papel dentro de un organismo más grande. Arriba ya vimos que una ventaja puede haber sido la producción colectiva de ciertas sustancias, o la capacidad de sobrevivir en ambientes con pocos alimentos. Otras ventajas de la multicelularidad que han sido propuestas, incluyen la supervivencia frente a depredadores (un depredador unicelular no puede comerse una colonia), y la capacidad que tiene una colonia de realizar múltiples tareas a la vez (un organismo unicelular no puede dividirse y a la vez mantener un flagelo para moverse, pero un organismo multicelular sí puede hacerlo) [lxxii].
Los primeros organismos multicelulares
La multicelularidad, tal como ya se mencionó, se desarrolló múltiples veces durante la historia de nuestro planeta. El auge de los organismos multicelulares empezó a finales del Proterozoico (a lo cual dedicaremos una próxima entrega). Pero mucho tiempo antes ya empezaron a aparecer organismos multicelulares. Tal como ocurre en el caso de los eucariontes, existen dudas acerca de la veracidad de los indicios de los primeros organismos multicelulares. Pero últimamente han aparecido indicios de que la multicelularidad apareció temprano: poco tiempo después de la aparición del oxígeno en la atmósfera. (En principio, todos los organismos multicelulares son aeróbicos; sólo de los loricíferos – milimétricos animales marinos – se sabe que viven en la ausencia de oxígeno [lxxiii].)
Los restos más viejos que pueden ser atribuidos a organismos multicelulares, datan de hace 2400 millones de años (cuando la cantidad de oxígeno en la atmósfera era todavía muy baja): se trata de posibles filamentos, ya mencionados arriba, que se parecen al micelio de hongos, que son organismos multicelulares (ver imagen, arriba) [lxxiv]. También se mencionaron arriba las estructuras encontradas en rocas en Gabón con una edad de 2100 millones de años, que han sido interpretadas como los restos de un organismo colonial o inclusive multicelular [lxxv]. Pero estos hallazgos siguen controvertidos, aunque datos genéticos también sugieren que la aparición de los organismos multicelulares coincidió con la Gran Oxidación de hace 2300 millones de años. Esta coincidencia tal vez no sea, valga la redundancia, tal coincidencia [lxxvi].
Una edad tan vieja para los primeros organismos multicelulares causa problemas con la edad del LECA, el primer antepasado común de los eucariontes actuales, que tal vez vivió hace unos 1800 millones de años. Al ser los multicelulares y los eucariontes unicelulares descendientes del LECA, el LECA necesariamente es más viejo. Este problema puede ser resuelto suponiendo que el LECA en la realidad es más viejo, o que los primeros organismos multicelulares, anteriores al LECA, pertenecen a linajes ahora desaparecidas – o que los estos organismos en la realidad no son eucariontes, un multicelulares.
Por tanto, son menos controvertidos ciertos fósiles de hace 1600 millones de años, de India y China. En India se encontraron filamentos de algas rojas, mostrando estructuras celulares, ya mencionadas arriba [lxxvii]. En China se hallaron fósiles claramente multicelulares, en forma de manto, de hasta 30 cm de largo [lxxviii]. Seguramente fue también multicelular el alga roja Bangiomorpha [lxxix], de hace 1047 millones de años [lxxx] (ver imagen). Las algas rojas son eucariontes capaces de fotosíntesis, debido a un evento de endosimbiosis, parecido al que ocurrió al inicio del Proterozoico en las plantas.
La atmósfera proterozoica
Tal como ya se mencionó en la entrega anterior, durante el Proterozoico hubo oxígeno en la atmósfera, aunque en cantidades muy menores a las actuales. Los organismos en aquel tiempo producían suficiente oxígeno para mantener tales niveles de oxígeno. Esta producción de oxígeno quedó evidenciada, entre otras cosas, por burbujas fosilizadas, probablemente de oxígeno, encontradas en rocas formadas como alfombras bacterianas, con una edad de 1600 millones de años [lxxxi].
Un compuesto que puede haber estado presente en la atmósfera proterozoica, es el óxido de nitrógeno (N2O), que pudo haberse formado en el océano por la reacción de hierro disuelto en agua con nitrógeno. Este gas tiene un importante efecto invernadero, y se piensa que ayudó a mantener la temperatura de la atmósfera a niveles suficientemente altos para el desarrollo de la vida [lxxxii]. Este papel fue importante, ya que el metano, el principal gas invernadero antes de la Gran Oxidación, había sido eliminado en buena parte de la atmósfera terrestre debido a reacciones con no sólo el oxígeno en el aire, sino también los sulfatos en el agua [lxxxiii].
A pesar de la presencia de oxígeno, es posible que, por lo menos en ciertos momentos y lugares, hubiera gases típicos de la atmósfera primitiva de la tierra, tales como el hidrógeno y el metano: se encontró agua con una edad de entre 1500 y 2700 millones de años en el subsuelo de Sudáfrica, que contiene estos gases y, además, isótopos de gases nobles, que permitieron datar el agua [lxxxiv].
Los continentes proterozoicos
Al inicio del Proterozoico, poco después de la Gran Oxidación, ocurrió una importante reorganización de los continentes terrestres: si antes de hace 2300 millones de años los continentes eran poco más que grandes islas de material granítico, hace 2200 millones de años, después de un intervalo más bien tranquilo, empezó una nueva fase tectónica: las placas de las que se compone la corteza terrestre empezaron a moverse, y donde éstas chocaban se formaron cadenas montañosas. Así aparecieron los primeros continentes, tal como los conocemos en la actualidad: con un núcleo antiguo, rodeado por montañas y llanuras (cuencas sedimentarias). Al amalgamarse múltiples continentes, se formó, hace unos 1600 millones de años, el primer súper-continente, denominado Nuna [lxxxv]. Nuna tuvo una vida muy larga: fue sólo a finales del Proterozoico que Rodinia, el súper-continente en el que se transformó Nuna, empezara a fragmentarse, resultando en lo que pasaron a ser los núcleos de los continentes que conocemos en la actualidad [lxxxvi].
El océano de Canfield
Los océanos del Proterozoico no eran siempre muy placenteros. Eran parcialmente sulfídicos (o sea, olían a huevos podridos), y sólo en parte oxigenados. Desde que esta situación fue descrita por vez primera por el geólogo y ecólogo estadounidense Donald Canfield [lxxxvii] (nac. 1957), esto se llama el “Océano de Canfield”.
Basándose en estudios de los isótopos de azufre en depósitos marinos del Proterozoico, Canfield determinó que, a raíz de la Gran Oxidación de hace 2300 millones de años, al inicio del Proterozoico (ver entrega anterior), grandes cantidades de sulfatos (azufre oxidado) empezaron a llegar a los océanos, traídos por ríos, lluvia, etc. En el océano, que inicialmente estaba bien oxidado [lxxxviii], los sulfatos empezaron a convertirse en sulfuros (H2S) mediante un proceso de reducción. Los sulfuros se combinaron con el hierro en el agua y formaron minerales de hierro, lo que dio origen a la formación, hace unos 1800 millones de años, de depósitos ricos en hierro en el fondo marino (ver línea de tiempo, arriba). Después de esta fase, los océanos profundos se mantuvieron euxínicos (o sea, sulfúricos y anaeróbicos), situación a la que contribuyeron organismos procariontes capaces de fotosíntesis anaeróbica, utilizando azufre en lugar de oxígeno [lxxxix]. Sólo en las aguas someras había cierta cantidad de oxígeno. Esta situación persistió hasta finales del Proterozoico, o sea, durante más de mil millones de años, aunque con fluctuaciones en la extensión de las aguas anaeróbicas [xc] y con alternancia entre fases de condiciones euxínicas y condiciones ferruginosas (anaeróbicas con presencia de hierro) [xci].
Hoy en día, las condiciones euxínicas son raras; el principal ejemplo actual de un mar euxínico es el Mar Negro (llamado en la Antigüedad Euxeinos Pontos – de allí el término “euxínico”), donde sólo las aguas superficiales son oxigenadas: por debajo de una profundidad de 100 metros las aguas son sulfúricas y anaeróbicas [xcii].
Los mil millones de años aburridos
Es de esperar que los sulfuros en el océano de Canfield hayan afectado el desarrollo de los eucariontes [xciii]. En efecto, una vez aparecidos los eucariontes, parece que se estancó su evolución. Hubo un retraso de mil millones de años entre el origen de los eucariontes y su diversificación, pues las bacterias dominaron la biosfera hasta hace unos 800 millones de años. Este intervalo de estabilidad ambiental, litosférica y evolutiva se conoce por el nombre de «boring billion» (aburridos mil millones de años) – un término acuñado por el biólogo inglés Martin Brasier (1947-2014) [xciv]. Ocurrieron muchas cosas, obviamente – tales como los cambios en el mundo biológico y las condiciones físicas de la tierra de los que ya hablamos – pero, al parecer, los eucariontes, después de aparecer, tardaron mucho tiempo en empezar a desarrollarse.
Se ha propuesto una variedad de explicaciones por este retraso. La baja concentración de oxígeno en la atmósfera probablemente resultó en períodos de anoxia (falta de oxígeno) en por lo menos parte los océanos, lo que dificultó el desarrollo de eucariontes más complejos [xcv]. Debido a la baja concentración de oxígeno en los océanos puede haber habido una escasez de metales críticos para el desarrollo de los eucariontes [xcvi], tales como el zinc [xcvii], hasta finales del Proterozoico. Otras explicaciones están relacionadas con el aumento limitado del oxígeno en la atmósfera, que no alcanzó los niveles ideales para los eucariontes hasta el final de dicho período [xcviii].
También es posible que haya habido una escasez de fósforo, elemento clave para varias biomoléculas, hasta ese mismo tiempo [xcix]. Otro elemento clave que escaseaba durante el Proterozoico fue el molibdeno, puesto que este elemento sólo es soluble en el agua en la presencia de oxígeno; el molibdeno es crítico para que bacterias puedan fijar nitrógeno, y si tales bacterias no podían alcanzar suficiente abundancia, los eucariontes – que por sí solos no pueden fijar nitrógeno y por ende dependen de bacterias para ello – no podían desarrollarse [c].
El retraso se debió posiblemente también a la dificultad de la introducción de nuevos organismos en una biosfera ocupada enteramente por los procariotas; por ejemplo, durante mucho tiempo los eucariontes se encontraron más en las aguas frías de las altas latitudes, y no tanto en las aguas calientes tropicales, donde vivían mayormente los procariontes [ci].
(Algunos investigadores evitan el problema del retraso, postulando que los eucariontes aparecieron más tarde, hace unos 900 millones de años [cii]; pero esta opinión está contradicha por las evidencias mencionadas arriba acerca del origen de los eucariontes.)
A finales del Proterozoico empezó la diversificación de los eucariontes. Esta se deja explicar en gran medida por la aparición de los animales en aquel entonces, que causó una ramificación dramática de este nuevo modelo de organismos [ciii]. Nuevas especies empezaron a aparecer en un ritmo más o menos constante (una especie dando origen a otra en un lapso de unos dos millones de años), y a pesar de este ritmo alto parece que los eucariontes nunca lograron llenar todos los nichos disponibles [civ]. Los procariontes, sin embargo, perdieron la hegemonía que tenían antes de la aparición de los eucariontes, y también se quedaron atrás en la tasa de aparición de nuevas especies [cv].
Fósiles de la mayoría de los grupos modernos de Eukarya se conocen desde el Ediacárico o el Cámbrico, hace unos 600-500 Ma [cvi], cuando ocurrió la Explosión Cámbrica, de la que hablaremos próximamente.
Conclusión
El Proterozoico fue un eón largo, con su duración de 2000 millones de años, en el que ocurrieron varios acontecimientos trascendentales para la historia de la tierra, separados por intervalos, “aburridos”, en los que poco parecía pasar. Los principales acontecimientos estaban relacionados al desarrollo de la vida, específicamente de los eucariontes. Al inicio del Proterozoico, cuando ocurrió la Gran Oxidación (en parte causada por la aparición de la fotosíntesis aeróbica), aparecieron los primeros eucariontes, aunque la fecha exacta de su aparición permanece, por los momentos, incierta. Después, hace 1600 millones de años o antes, aparecieron los primeros organismos eucariontes multicelulares. Estos dos eventos clave, ambos relacionados a cambios en el entorno, principalmente el aumento de la concentración de oxígeno en la atmósfera, son los dos principales saltos en tamaño de los organismos registrados durante la historia de nuestro planeta [cvii].
Al final del Proterozoico se dio otro evento clave en la historia de la tierra, con un paralelismo sorprendente con los acontecimientos al inicio del Proterozoico: ocurrió otra explosión de la vida (esta vez marcada por la aparición de los animales), acompañada de la más extrema edad de hielo que conoció nuestro planeta, y el segundo gran aumento de la proporción de oxígeno en la atmósfera. De estos acontecimientos hablaremos en una próxima entrega.
Nota: la foto en el encabezado de esta entrega muestra el fósil de un organismo multicelular de hace 600 millones de años, mostrando una diversificación de células. Crédito: Virginia Tech. Fuente: https://phys.org/news/2015-02-multicellular-life-evolve.html.
[i] Ver: https://es.wikipedia.org/wiki/E%C3%B3n_Proterozoico.
[ii] Ver: https://es.wikipedia.org/wiki/Eukaryota.
[iii] Cavalier-Smith, T., 2014. The Neomuran Revolution and phagotrophic origin of eukaryotes and cilia in the light of intracellular coevolution and a revised tree of life. Cold Spring Harbor Perspectives in Biology, 6, a016006. https://cshperspectives.cshlp.org/content/6/9/a016006.full.pdf.
[iv] Guy, L., Saw, J.H. y Ettema, T.J.G., 2014. The Archaeal legacy of Eukaryotes: A phylogenomic perspective. Cold Spring Harbor Perspectives in Biology, 6, a016022. https://cshperspectives.cshlp.org/content/6/10/a016022.full.pdf.
[v] Ver: https://es.wikipedia.org/wiki/Eukaryota.
[vi] Sagan, L., 1967. On the origin of mitosing cells. Journal of Theoretical Biology, 14 (3), 225-274. www.sciencedirect.com/science/article/pii/0022519367900793. [Sagan era el apellido del primer marido de la investigadora, Margulis él del segundo.]
[vii] Ver: https://es.wikipedia.org/wiki/Lynn_Margulis.
[viii] Ku, C. y otros, 2015. Endosymbiotic origin and differential loss of eukaryotic genes. Nature, 524, 427-432. www.nature.com/articles/nature14963.
[ix] Ver: https://es.wikipedia.org/wiki/Mitocondria.
[x] Woese, C.R., 1977. Endosymbionts and mitochondrial origins. Journal of Molecular Evolution, 10 (2), 93-96. https://link.springer.com/article/10.1007%2FBF01751802. Sleep, N.H. y Bird, D.K., 2008. Evolutionary ecology during the rise of dioxygen in the Earth’s atmosphere. Philosophical Transactions of the Royal Society B, 363, 2651-2664. https://royalsocietypublishing.org/doi/pdf/10.1098/rstb.2008.0018.
[xi] Lake, J.A., 2009. Evidence for an early prokaryotic endosymbiosis. Nature, 460, 967-971. www.nature.com/articles/nature08183.
[xii] Martijn, J., Vosseberg, J., Guy, L., Offre, P. y Ettema, T.J.G., 2018. Deep mitochondrial origin outside the sampled alphaproteobacteria. Nature, 557, 101-105. www.nature.com/articles/s41586-018-0059-5.
[xiii] Ver: https://blogs.scientificamerican.com/lab-rat/the-origin-of-breathing-how-bacteria-learnt-to-use-oxygen/.
[xiv] Gray, M.W., 2014. The Pre-Endosymbiont Hypothesis: A new perspective on the origin and evolution of mitochondria. Cold Spring Harbor Perspectives in Biology, 6, a016097. https://cshperspectives.cshlp.org/content/6/3/a016097.full.pdf. Ver también: https://es.wikipedia.org/wiki/Eukaryota.
[xv] Embley, T.M., 2006. Multiple secondary origins of the anaerobic lifestyle in eukaryotes. Philosophical Transactions of the Royal Society B, 361, 1055-1067. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2006.1844.
[xvi] Pittis, A.A. y Gabaldón, T., 2016. Late acquisition of mitochondria by a host with chimaeric prokaryotic ancestry. Nature, 531, 101-104. www.nature.com/articles/nature16941.
[xvii] Fedonkin, M.A., 2003. The origin of the Metazoa in the light of the Proterozoic fossil record. Paleontological Research, 7 (1), 9-41. https://doi.org/10.2517/prpsj.7.9.
[xviii] McFadden, G.I., 2014. Origin and evolution of plastids and photosynthesis in eukaryotes. Cold Spring Harbor Perspectives in Biology, 6, a016105. https://cshperspectives.cshlp.org/content/6/4/a016105.full.pdf.
[xix] Douglas, A.E., 2014. Symbiosis as a general principle in eukaryotic evolution. Cold Spring Harbor Perspectives in Biology, 6, a016113. https://cshperspectives.cshlp.org/content/6/2/a016113.full.pdf.
[xx] Moreira, D. y Deschamps, P., 2014. What was the real contribution of endosymbionts to the eukaryotic nucleus? Insights from photosynthetic eukaryotes. Cold Spring Harbor Perspectives in Biology, 6, a016014. https://cshperspectives.cshlp.org/content/6/7/a016014.full.pdf.
[xxi] Gottshall, E.Y., Seebart, C., Gatlin, J.C. y Ward, N.L., 2014. Spatially segregated transcription and translation in cells of the endomembrane-containing bacterium Gemmata obscuriglobus. Proceedings of the National Academy of Sciences, 111 (30), 11067-11072. www.pnas.org/content/111/30/11067.
[xxii] Goodenough, U. y Heitman, J., 2014. Origins of eukaryotic sexual reproduction. Cold Spring Harbor Perspectives in Biology, 6, a016154. https://cshperspectives.cshlp.org/content/6/3/a016154.full.pdf.
[xxiii] Devos, D.P. y Reynaud, E.G., 2010. Intermediate steps. Science, 330 (6008), 1187-1188. http://science.sciencemag.org/content/330/6008/1187.
[xxiv] Baum, D.A. y Baum, B., 2014. An inside-out origin for the eukaryotic cell. BMC Biology, 12, 76. https://doi.org/10.1186/s12915-014-0076-2.
[xxv] Lane, N., 2014. Bioenergetic constraints on the evolution of complex life. Cold Spring Harbor Perspectives in Biology, 6, a015982. https://cshperspectives.cshlp.org/content/6/5/a015982.full.pdf. Lane, N. Y Martin, W., 2010. The energetics of genome complexity. Nature, 467, 929-934. www.nature.com/articles/nature09486.
[xxvi] Fritz-Laylin, L.K. y otros, 2010. The genome of Naegleria gruberi illuminates early eukaryotic versatility. Cell, 140 (5), P631-642. www.cell.com/action/showPdf?pii=S0092-8674%2810%2900067-X.
[xxvii] Derelle, R., Torruella, G., Klimeš, V., Brinkmann, H., Kim, E., Vlček, Č., Lang, B.F. y Eliáš, M., 2015. Bacterial proteins pinpoint a single eukaryotic root. Proceedings of the National Academy of Sciences, 112 (7), E693-E699. www.pnas.org/content/112/7/E693.
[xxviii] Knoll, A.H., 2014. Paleobiological perspectives on early eukaryotic evolution. Cold Spring Harbor Perspectives in Biology, 6, a016121.
[xxix] Burki, F., 2014. The eukaryotic tree of life from a global phylogenomic perspective. Cold Spring Harbor Perspectives in Biology, 6, a016147. https://cshperspectives.cshlp.org/content/6/5/a016147.full.pdf.
[xxx] Koonin, E.V. y Yutin, N., 2014. The dispersed archaeal eukaryome and the complex archaeal ancestor of eukaryotes. Cold Spring Harbor Perspectives in Biology, 6, a016188. https://cshperspectives.cshlp.org/content/6/4/a016188.full.pdf.
[xxxi] Guy, L. y Ettema, T.J.G., 2011. The archaeal ‘TACK’ superphylum and the origin of eukaryotes. Trends in Microbiology, 19 (12), P580-587. www.cell.com/trends/microbiology/fulltext/S0966-842X(11)00174-0.
[xxxii] Zaremba-Niedzwiedzka, K. y otros, 2017. Asgard archaea illuminate the origin of eukaryotic cellular complexity. Nature, 541, 353-358. www.nature.com/articles/nature21031. Eme, L., Spang, A., Lombard, J., Stairs, C.W. y Ettema, T.J.G., 2017. Archaea and the origin of eukaryotes. Nature Reviews Microbiology, 15, 711-723. www.nature.com/articles/nrmicro.2017.133.
[xxxiii] Spang, A. y otros, 2015. Complex archaea that bridge the gap between prokaryotes and eukaryotes. Nature, 521, 173-179. www.nature.com/nature/journal/v521/n7551/pdf/nature14447.pdf. Embley, T.M. y Williams, T.A., 2015. Steps on the road to eukaryotes. Nature, 521, 169-170. www.nature.com/nature/journal/v521/n7551/pdf/nature14522. Dey, G., Thattai, M. y Baum, B., 2016. On the Archaeal origins of eukaryotes and the challenges of inferring phenotype from genotype. Cold Spring Harbor Trends in Cell Biology, 26 (7), 476-485. www.cell.com/trends/cell-biology/pdf/S0962-8924(16)30002-2.pdf.
[xxxiv] Lai, S., Safaei, J. y Pelech, S., 2016. Evolutionary ancestry of eukaryotic protein kinases and choline kinases. The Journal of Biological Chemistry, 291, 5199-5205. www.jbc.org/content/291/10/5199.short.
[xxxv] Ver: https://es.wikipedia.org/wiki/Transposón.
[xxxvi] Lee, G. y otros, 2018. Testing the retroelement invasion hypothesis for the emergence of the ancestral eukaryotic cell. Proceedings of the National Academy of Sciences, 115 (49), 12465-12470. www.pnas.org/content/115/49/12465.
[xxxvii] Roger, A.J. y Hug, L.A., 2006. The origin and diversification of eukaryotes: problems with molecular phylogenetics and molecular clock estimation. Philosophical Transactions of the Royal Society B, 361, 1039-1054. https://royalsocietypublishing.org/doi/10.1098/rstb.2006.1845.
[xxxviii] Butterfield, N.J., 2015. Early evolution of the Eukaryota. Palaeontology, 58 (1), 5-17. https://onlinelibrary.wiley.com/doi/pdf/10.1111/pala.12139.
[xxxix] Betts, H.C., Puttick, M.N., Clark, J.W., Williams, T.A., Donoghue, P.C.J. y Pisani, D., 2018. Integrated genomic and fossil evidence illuminates life’s early evolution and eukaryote origin. Nature Ecology & Evolution, 2, 1556-1562. www.nature.com/articles/s41559-018-0644-x.
[xl] Knoll, A.H., Javaux, E.J., Hewitt, D. y Cohen, P., 2006. Eukaryotic organisms in Proterozoic oceans. Philosophical Transactions of the Royal Society B, 361, 1023-1038. https://royalsocietypublishing.org/doi/10.1098/rstb.2006.1843.
[xli] El Albani, A. y otros, 2010. Large colonial organisms with coordinated growth in oxygenated environments 2.1 Gyr ago. Nature, 466, 100-104. www.nature.com/articles/nature09166. El Albani, A. y otros, 2014. The 2.1 Ga old Francevillian biota: biogenicity, taphonomy and biodiversity. PLOS ONE, 9 (6), e99438. https://doi.org/10.1371/journal.pone.0099438. El Albani, A. y otros, 2019. Organism motility in an oxygenated shallow-marine environment 2.1 billion years ago. Proceedings of the National Academy of Sciences, 116 (9), 3431-3436. www.pnas.org/content/116/9/3431.
[xlii] Retallack, G.J., Krull, E.S., Thackray, G.D. y Parkinson, D., 2013. Problematic urn-shaped fossils from a Paleoproterozoic (2.2 Ga) paleosol in South Africa. Precambrian Research, 235, 71-87. www.sciencedirect.com/science/article/pii/S0301926813001812.
[xliii] Bengtson, S., Rasmussen, B., Ivarsson, M., Muhling, J., Broman, C., Marone, F., Stampanoni, M. y Bekker, A., 2017. Fungus-like mycelial fossils in 2.4-billion-year-old vesicular basalt. Nature Ecology & Evolution, 1, 0141. www.nature.com/articles/s41559-017-0141.
[xliv] Brocks, J.J., Logan, G.A., Buick, R. y Summons, R.E., 1999. Archean molecular fossils and the early rise of eukaryotes. Science, 285 (5430), 1033-1036. http://science.sciencemag.org/content/sci/285/5430/1033.full.pdf.
[xlv] Rasmussen, B., Fletcher, I.R., Brocks, J.J. y Kilburn, M.R., 2008. Reassessing the first appearance of eukaryotes and cyanobacteria. Nature, 455, 1101-1104. www.nature.com/articles/nature07381. French, K.L. y otros, 2015. Reappraisal of hydrocarbon biomarkers in Archean rocks. Proceedings of the National Academy of Sciences, 112 (19), 5915-5920. www.pnas.org/content/pnas/112/19/5915.full.pdf. Knoll, 2014. Ver nota 28.
[xlvi] Gold, D.A., Caron, A., Fournier, G.P. y Summons, R.E., 2017. Paleoproterozoic sterol biosynthesis and the rise of oxygen. Nature, 543, 420-423. www.nature.com/articles/nature21412.
[xlvii] Kaźmierczak, J., Kremer, B., Altermann, W. y Franchi, I., 2016. Tubular microfossils from ∼2.8 to 2.7 Ga-old lacustrine deposits of South Africa: A sign for early origin of eukaryotes? Precambrian Research, 286, 180-194. www.sciencedirect.com/science/article/pii/S0301926816301401.
[xlviii] Ver: https://es.wikipedia.org/wiki/Eukaryota.
[xlix] Javaux, E.J., Knoll, A.H. y Walter, M.R., 2001. Morphological and ecological complexity in early eukaryotic ecosystems. Nature, 412, 66-69. www.nature.com/articles/35083562. Butterfield, 2015. Ver nota 38.
[l] Ver: https://es.wikipedia.org/wiki/Tappania.
[li] Adam, Z. y Butterfield, N.J., 2016. Evidence of sexual conjugation and crown-group status in early Proterozoic eukaryotes. Geological Society of America Abstracts with Programs, 48 (7), 118-1. https://gsa.confex.com/gsa/2016AM/webprogram/Paper287359.html.
[lii] Bengtson, S., Belivanova, V., Rasmussen, B. y Whitehouse, M., 2009. The controversial “Cambrian” fossils of the Vindhyan are real but more than a billion years older. Proceedings of the National Academy of Sciences, 106 (19), 7729-7734. www.pnas.org/content/106/19/7729. Bengtson, S., Sallstedt, T., Belivanova, V. y Whitehouse, M., 2017. Three-dimensional preservation of cellular and subcellular structures suggests 1.6 billion-year-old crown-group red algae. PLoS Biology, 15 (3), e2000735. http://journals.plos.org/plosbiology/article/file?id=10.1371/journal.pbio.2000735&type=printable.
[liii] Butterfield, 2015. Ver nota 38.
[liv] Poole, A.M. y Gribaldo, S., 2014. Eukaryotic origins: how and when was the mitochondrion acquired? Cold Spring Harbor Perspectives in Biology, 6, a015990. https://cshperspectives.cshlp.org/content/6/12/a015990.full.pdf.
[lv] Keeling, P.J., 2014. The impact of history on our perception of evolutionary events: endosymbiosis and the origin of eukaryotic complexity. Cold Spring Harbor Perspectives in Biology, 6, a016196. https://cshperspectives.cshlp.org/content/6/2/a016196.full.pdf.
[lvi] McFadden, 2014. Ver nota 18. Knoll, 2014. Ver nota 28.
[lvii] Parnell, J., Hole, M., Boyce, A.J., Spinks, S. y Bowden, S., 2012. Heavy metal, sex and granites: Crustal differentiation and bioavailability in the mid-Proterozoic. Geology, 40 (8), 751-754. https://doi.org/10.1130/G33116.1.
[lviii] Ver: https://en.wikipedia.org/wiki/Eukaryote.
[lix] Niklas, K.J., 2014. The evolutionary‐developmental origins of multicellularity. American Journal of Botany, 101 (1), 6-25. https://doi.org/10.3732/ajb.1300314.
[lx] Koschwanez, J.H., Foster, K.R. y Murray, A.W., 2011. Sucrose utilization in budding yeast as a model for the origin of undifferentiated multicellularity. PLoS Biology, 9 (8), e1001122. https://doi.org/10.1371/journal.pbio.1001122.
[lxi] Hammerschmidt, K., Rose, C.J., Kerr, B. y Rainey, P.B., 2014. Life cycles, fitness decoupling and the evolution of multicellularity. Nature, 515, 75-79. www.nature.com/articles/nature13884.
[lxii] Ver: https://es.wikipedia.org/wiki/Choanoflagellatea.
[lxiii] Libby, E. y Ratcliff, W.C., 2014. Ratcheting the evolution of multicellularity. Science, 346 (6208), 426-427. https://science.sciencemag.org/content/346/6208/426.summary.
[lxiv] Goldsby, H.J., Dornhaus, A., Kerr, B. y Ofria, C., 2012. Task-switching costs promote the evolution of division of labor and shifts in individuality. Proceedings of the National Academy of Sciences, 109 (34), 13686-13691. www.pnas.org/content/109/34/13686.
[lxv] Gavrilets, S., 2010. Rapid transition towards the division of labor via evolution of developmental plasticity. PLoS Computational Biology, 6 (6), e1000805. https://doi.org/10.1371/journal.pcbi.1000805.
[lxvi] Rueffler,C., Hermisson, J. y Wagner, G.P., 2012. Evolution of functional specialization and division of labor. Proceedings of the National Academy of Sciences, 109 (6), E326-E335. www.pnas.org/content/109/6/E326.
[lxvii] Ratcliff, W.C., Denison, R.F., Borrello, M. y Travisano, M., 2012. Experimental evolution of multicellularity. Proceedings of the National Academy of Sciences, 109 (5), 1595-1600. www.pnas.org/content/109/5/1595.
[lxviii] Alegado, R.A., Brown, L.W., Cao, S., Dermenjian, R.K., Zuzow, R., Fairclough, S.R., Clardy, J. y King, N., 2012. A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. eLife, 1, e00013. https://elifesciences.org/articles/00013.
[lxix] Hanschen, E.R. y otros, 2016. The Gonium pectorale genome demonstrates co-option of cell cycle regulation during the evolution of multicellularity. Nature Communications, 7, 11370. www.nature.com/articles/ncomms11370.
[lxx] Anderson, D.P. y otros, 2016. Evolution of an ancient protein function involved in organized multicellularity in animals. eLife, 5, e10147. https://elifesciences.org/articles/10147.
[lxxi] Prochnik, S.E. y otros, 2010. Genomic analysis of organismal complexity in the multicellular green alga Volvox carteri. Science, 329 (5988), 223-226. https://science.sciencemag.org/content/329/5988/223.
[lxxii] Ver: https://www.newscientist.com/article/dn9951-top-10-lifes-greatest-inventions/#.U_CTWpUcSCg.
[lxxiii] Mentel, M. y Martin, W., 2010. Anaerobic animals from an ancient, anoxic ecological niche. BMC Biology, 8, 32. https://doi.org/10.1186/1741-7007-8-32. Danovaro, R., Dell’Anno, A., Pusceddu, A., Gambi, C., Heiner, I. y Møbjerg Kristensen, R., 2010. The first metazoa living in permanently anoxic conditions. BMC Biology, 8, 30. https://doi.org/10.1186/1741-7007-8-30. Levin, L.A., 2010. Anaerobic metazoans: No longer an oxymoron. BMC Biology, 8, 31. https://doi.org/10.1186/1741-7007-8-31.
[lxxiv] Bengtson y otros, 2017. Ver nota 43.
[lxxv] El Albani y otros, 2010, 2014 y 2019. Ver nota 41.
[lxxvi] Schirrmeister, B.E., de Vos, J.M., Antonelli, A. y Bagheri, H.C., 2013. Evolution of multicellularity coincided with increased diversification of cyanobacteria and the Great Oxidation Event. Proceedings of the National Academy of Sciences, 110 (5), 1791-1796. www.pnas.org/content/110/5/1791.
[lxxvii] Bengtson y otros, 2017. Ver nota 52.
[lxxviii] Zhu, S. y otros, 2016. Decimetre-scale multicellular eukaryotes from the 1.56-billion-year-old Gaoyuzhuang Formation in North China. Nature Communications, 7, 11500. www.nature.com/articles/ncomms11500.
[lxxix] Butterfield, 2015. Ver nota 38.
[lxxx] Gibson, T.M. y otros, 2017. Precise age of Bangiomorpha pubescens dates the origin of eukaryotic photosynthesis. Geology, 46 (2), 135-138. https://doi.org/10.1130/G39829.1. Butterfield, N.J., 2000. Bangiomorpha pubescens n. gen., n. sp.: implications for the evolution of sex, multicellularity, and the Mesoproterozoic/Neoproterozoic radiation of eukaryotes. Paleobiology, 26 (3), 386-404. https://doi.org/10.1666/0094-8373(2000)026<0386:BPNGNS>2.0.CO;2.
[lxxxi] Sallstedt, T., Bengtson, S., Broman, C., Crill, P.M. y Canfield, D.E., 2018. Evidence of oxygenic phototrophy in ancient phosphatic stromatolites from the Paleoproterozoic Vindhyan and Aravalli Supergroups, India. Geobiology, 16 (2), 139-159. https://doi.org/10.1111/gbi.12274.
[lxxxii] Stanton, C.L., Reinhard, C.T., Kasting, J.F., Ostrom, N.E., Haslun, J.A., Lyons, T.W. y Glass, J.B., 2018. Nitrous oxide from chemodenitrification: A possible missing link in the Proterozoic greenhouse and the evolution of aerobic respiration. Geobiology, 16 (6), 597-609. https://doi.org/10.1111/gbi.12311.
[lxxxiii] Olson, S.L., Reinhard, C.T. y Lyons, T.W., 2016. Limited role for methane in the mid-Proterozoic greenhouse. Proceedings of the National Academy of Sciences, 113 (41), 11447-11452. www.pnas.org/content/113/41/11447.
[lxxxiv] Holland, G., Sherwood Lollar, B., Li, L., Lacrampe-Couloume, G., Slater, G.F. y Ballentine, C.J., 2013. Deep fracture fluids isolated in the crust since the Precambrian era. Nature, 497, 357-360. www.nature.com/articles/nature12127.
[lxxxv] Spencer, C.J., Murphy, J.B., Kirkland, C.L., Liu, Y. y Mitchell, R.N., 2018. A Palaeoproterozoic tectono-magmatic lull as a potential trigger for the supercontinent cycle. Nature Geoscience, 11, 97-101. www.nature.com/articles/s41561-017-0051-y.
[lxxxvi] Cawood, P.A. y Hawkesworth, C.J., 2014. Earth’s middle age. Geology, 42 (6), 503-506. https://doi.org/10.1130/G35402.1.
[lxxxvii] Canfield, D.E., 1998. A new model for Proterozoic ocean chemistry. Nature, 396, 450-453. www.nature.com/articles/24839.
[lxxxviii] Canfield, D.E. y otros, 2013. Oxygen dynamics in the aftermath of the Great Oxidation of Earth’s atmosphere. Proceedings of the National Academy of Sciences, 110 (42), 16736-16741. www.pnas.org/content/110/42/16736.
[lxxxix] Johnston, D.T., Wolfe-Simon, F., Pearson, A. Knoll, A.H., 2009. Anoxygenic photosynthesis modulated Proterozoic oxygen and sustained Earth’s middle age. Proceedings of the National Academy of Sciences, 106 (40), 16925-16929. www.pnas.org/content/106/40/16925. Lyons, T.W. y Reinhard, C.T., 2009. An early productive ocean unfit for aerobics. Proceedings of the National Academy of Sciences, 106 (43), 18045-18046. www.pnas.org/content/pnas/106/43/18045.full.pdf.
[xc] Canfield, 1998. Ver nota 87. Poulton, S.W., Fralick, P.W. y Canfield, D.E., 2004. The transition to a sulphidic ocean 1.84 billion years ago. Nature, 431, 173-177. www.nature.com/articles/nature02912. Poulton, S.W., Fralick, P.W. y Canfield, D.E., 2010. Spatial variability in oceanic redox structure 1.8 billion years ago. Nature Geoscience, 3, 486-490. www.nature.com/articles/ngeo889.
[xci] Boyle, R.A., Clark, J.R., Poulton, S.W., Shields-Zhou, G., Canfield, D.E. y Lenton, T.M., 2013. Nitrogen cycle feedbacks as a control on euxinia in the mid-Proterozoic ocean. Nature Communications, 4, 1533. www.nature.com/articles/ncomms2511.
[xcii] Lyons y Reinhard, 2009. Ver nota 89.
[xciii] Poulton y otros, 2010. Ver nota 90. Johnston y otros, 2009. Ver nota 89.
[xciv] Ver: https://en.wikipedia.org/wiki/Boring_Billion#cite_note-:1-1. Brasier, M.D. y Lindsay, J.F., 1998. A billion years of environmental stability and the emergence of eukaryotes: New data from northern Australia. Geology, 26 (6), 555-558. https://doi.org/10.1130/0091-7613(1998)026<0555:ABYOES>2.3.CO;2.
[xcv] Reinhard, C.T., Planavsky, N.J., Olson, S.L., Lyons, T.W. y Erwin, D.H., 2016. Earth’s oxygen cycle and the evolution of animal life. Proceedings of the National Academy of Sciences, 113 (32), 8933-8938. https://doi.org/10.1073/pnas.1521544113.
[xcvi] Anbar, A.D. y Knoll, A.H., 2002. Proterozoic ocean chemistry and evolution: a bioinorganic bridge? Science, 297 (5584), 1137-1142. http://science.sciencemag.org/content/297/5584/1137.
[xcvii] Isson, T.T. y otros, 2018. Tracking the rise of eukaryotes to ecological dominance with zinc isotopes. Geobiology, 16 (4), 341-352. https://onlinelibrary.wiley.com/doi/abs/10.1111/gbi.12289.
[xcviii] Blamey, N.J.F., Brand, U., Parnell, J., Spear, N., Lécuyer, C., Benison, K., Meng, F. y and Ni, P., 2016. Paradigm shift in determining Neoproterozoic atmospheric oxygen. Geology, 44 (8), 651-654. http://geology.gsapubs.org/content/44/8/651.full.pdf.
[xcix] Planavsky, N.J., Rouxel, O.J., Bekker, A., Lalonde, S.V., Konhauser, K.O., Reinhard, C.T. y Lyons, T.W., 2010. The evolution of the marine phosphate reservoir. Nature, 467, 1088-1090. www.nature.com/articles/nature09485. Reinhard, C.T. y otros, 2017. Evolution of the global phosphorus cycle. Nature, 541, 386-389. www.nature.com/articles/nature20772.
[c] Scott, C., Lyons, T.W., Bekker, A., Shen, Y., Poulton, S.W., Chu, X. y Anbar, A.D., 2008. Tracing the stepwise oxygenation of the Proterozoic ocean. Nature, 452, 456-459. www.nature.com/articles/nature06811. Dahl, T.W., Canfield, D.E., Rosing, M.T., Frei, R.E., Gordon, G.W., Knoll, A.H. y Anbar, A.D., 2011. Molybdenum evidence for expansive sulfidic water masses in ~ 750 Ma oceans. Earth and Planetary Science Letters, 311, (3-4), 264-274. https://doi.org/10.1016/j.epsl.2011.09.016.
[ci] Fedonkin, 2003. Ver nota 17.
[cii] Cavalier-Smith, T., 2006. Cell evolution and Earth history: stasis and revolution. Philosophical Transactions of the Royal Society B, 361, 969-1006. https://royalsocietypublishing.org/doi/full/10.1098/rstb.2006.1842.
[ciii] Butterfield, 2015. Ver nota 38. Ver también: https://es.wikipedia.org/wiki/Eukaryota.
[civ] Hedges, S.B., Marin, J., Suleski, M., Paymer, M. y Kumar, S., 2015. Tree of life reveals clock-like speciation and diversification. Molecular Biology and Evolution, 32 (4), 835-845. http://mbe.oxfordjournals.org/content/32/4/835.full.pdf.
[cv] Marin, J., Battistuzzi, F.U., Brown, A.C. y Hedges, S.B., 2017. The timetree of prokaryotes: new insights into their evolution and speciation. Molecular Biology and Evolution, 34 (2), 437-446. https://academic.oup.com/mbe/article/34/2/437/2740734.
[cvi] Ver: https://es.wikipedia.org/wiki/Eukaryota.
[cvii] Payne, J.L. y otros, 2009. Two-phase increase in the maximum size of life over 3.5 billion years reflects biological innovation and environmental opportunity. Proceedings of the National Academy of Sciences, 106 (1), 24-27. www.pnas.org/content/106/1/24.

Un comentario en “Los albores de la vida (6): El Proterozoico – la edad media de la tierra”