En la entrega anterior ya vimos como los primeros animales aparecieron hace algo más de 700 millones de años, hacia finales del eón Proterozoico. En comparación con la poca vida que había existido antes en la tierra, esto fue un gran cambio. Pero por los momentos la variedad de animales se mantuvo baja, y los que había se dedicaban a alimentarse de las algas que abundaban, y de material orgánico en el agua – una situación pacífica que ha sido denominada el “Jardín de Ediacara”. Los ecosistemas eran muy distintos a los que conocemos hoy en día. Para que se pudiesen desarrollar estos últimos, hizo falta otra revolución en el reino animal: la Explosión Cámbrica. La Explosión Cámbrica, así llamada por su carácter bastante abrupto y su gran envergadura, puso fin a unos tres mil millones de años de lo que pudiéramos llamar la infancia de la vida. Veamos en esta entrega qué pasó en el Cámbrico, el primer período del actual eón: el Fanerozoico (ver la línea de tiempo).
Explosión cámbrica
La explosión cámbrica, o – en lenguaje más científico – la radiación evolutiva del Cámbrico, fue la aparición relativamente repentina de organismos macroscópicos multicelulares complejos al inicio del periodo Cámbrico, hace 541 millones de años (ver línea de tiempo), seguida por una rápida diversificación. Este período marca una brusca transición en el registro fósil con la aparición de los miembros más primitivos de muchos filos (linajes) de animales [1]. Entre los linajes que aparecieron en el Cámbrico, se encuentran los artrópodos (un filo que incluye, entre otros, los insectos, crustáceos y arácnidos), los moluscos, los equinodermos (erizos de mar), y los cordados (que incluye a subfilo de los vertebrados, al que pertenecemos también nosotros, los humanos) [2].
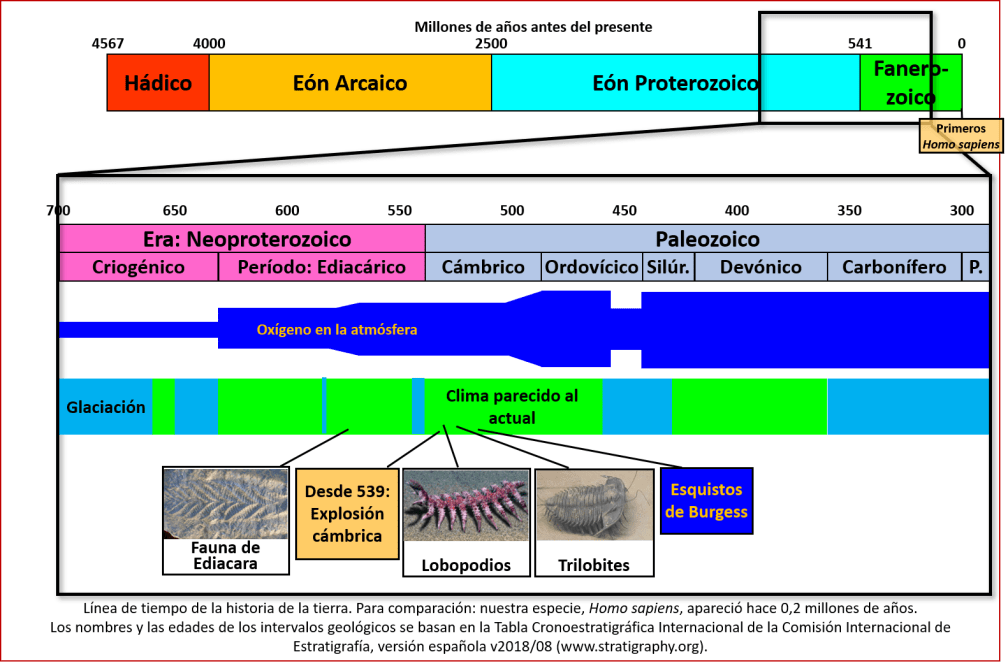
¿Cuán brusca fue esta transición? Al parecer ocurrió en un intervalo de alrededor de veinte millones de años, lo que no se puede llamar muy brusco. Sin embargo, hubo tres pulsos bien marcados, cada uno con una duración de un par de millones de años, en los que se dio la aparición de la mayoría de linajes nuevos: empezaron hace 540, 534 y 524 millones de años [3]. Recientemente se refinó la edad y duración del primer pulso: ocurrió en menos de medio millón de años, a partir de 538,8 millones de años antes del presente [4]. Esto sí que se puede llamar brusco, por lo menos de punto de vista geológico.
En este poco tiempo aparecieron muchas formas distintas de organismos, y no sólo de animales. Esta diversificación continuó en un período posterior, con otra fase importante cuando los animales poblaron los continentes [5], pero la primera gran radiación se dio al inicio del Cámbrico. Durante la explosión cámbrica, las tasas de aparición de nuevas especies de animales eran mucho mayores con respecto a todos los períodos sucesivos, lo que muestra que se trató de un fenómeno especial [6].
Ha habido, y sigue habiendo, discusiones acerca del alcance de la explosión cámbrica. ¿Cómo se puede definir el origen de un linaje, y determinar si de verdad se originó al inicio del Cámbrico [7]? ¿Cómo incorporar en los estudios los datos genéticos de los animales actuales, para reconstruir los orígenes de los linajes [8]? Varias líneas de estudio apuntan a que ciertos linajes ya habían aparecido en los tiempos del Ediacárico, el período antes del Cámbrico del que hablamos en la entrega anterior. Da la impresión de que, tal como ya vimos en esa entrega, algunos de los animales del Ediacárico pueden ser considerados los ancestros de linajes cuya diversificación ocurrió en el Cámbrico [9].
Detonantes de la explosión cámbrica
¿Cuál fue la causa de la explosión cámbrica? No lo sabemos con seguridad: existen varias hipótesis, pero ignoramos cuál es correcta, por sí sola o en combinación con otras hipótesis.
Las explicaciones propuestas para la explosión cámbrica caen, en su mayoría, en una de las siguientes categorías: (1) explicaciones genéticas y de desarrollo, (2) explicaciones ecológicas, y (3) explicaciones abióticas y ambientales. Dentro de esta última categoría se puede identificar una subcategoría de explicaciones geoquímicas. Muchas de estas explicaciones fueron propuestas como la única causa de la explosión cámbrica; sin embargo, muchas de ellas están relacionadas entre sí, y lo más probable es que un conjunto de factores haya causado la rápida diversificación de los animales [10].
Detonantes ambientales, abióticos y geoquímicos
Las hipótesis de naturaleza geoquímica se refieren a condiciones que hicieron posible la explosión cámbrica: condiciones probablemente necesarias, pero no necesariamente causas directas. En primer lugar: la disponibilidad de oxígeno en el aire y en las aguas del mar. Sin oxígeno no hay manera que los animales se pudiesen haber desarrollado. Tal como vimos en las entregas anteriores, la cantidad de oxígeno disponible, tanto en el mar como en el aire, era poca, hasta finales del Proterozoico [11] (ver línea de tiempo). En el Cámbrico, sin embargo, el oxígeno se volvió prácticamente tan común como lo es ahora, aunque con fluctuaciones [12]; este aumento estuvo ayudado por un incremento en la disponibilidad de nitrógeno fijado (o sea, en minerales, disponible para ser utilizado por los organismos) [13]. Esto indudablemente ayudó en el desarrollo y la diversificación de los animales [14]. Las innovaciones biológicas características de los animales ya estaban apareciendo a finales del Proterozoico, pero no fue hasta que las condiciones ambientales se volvieran permisivas que la gran radiación pudiera ocurrir [15].
Sin embargo, el principal aumento en la concentración de oxígeno en la atmósfera se dio más bien hacia finales del Cámbrico: después de 500 millones de años antes del presente [16]. Este pulso de oxigenación, que duró hasta el Ordovícico, el período que siguió al Cámbrico, ha sido considerado como uno de los detonantes de la radiación de los animales y otros organismos que ocurrió en ese período: la Gran Biodiversificación Ordovícica [17]. Esto implica que la explosión cámbrica se dio cuando los niveles de oxígeno todavía no eran tan altos como lo son ahora.
La importancia del oxígeno queda evidenciada en el acervo genético de los animales: desde los animales más primitivos, los primeros en aparecer, hasta nosotros, los humanos, tenemos un mecanismo para detectar la cantidad de oxígeno en el ambiente para que el cuerpo pueda tomar las acciones necesarias para que a todas las células les llegue suficiente oxígeno. Este mecanismo es tan antiguo como los animales y refleja cómo en el Cámbrico hubo oxígeno, pero no siempre en grandes cantidades [18].
Aparte del oxígeno, hubo otro factor geoquímico/ambiental importante que influyó sobre el desarrollo de los animales: una fase de actividad tectónica (es decir, movimientos de las placas de la corteza terrestre, formación de montañas, etc.) resultó en la inundación de zonas costeras de los continentes, formándose así extensos mares someros en los que se desarrollaron los animales; y causó la erosión de rocas en los continentes, lo que dio origen a un enriquecimiento de los mares en una multitud de elementos, incluyendo algunos de relevancia para el desarrollo de los animales [19]. Entre estos elementos se encuentran el calcio (del que hablaremos a continuación) y el fósforo, que todos los organismos necesitan y cuya escasez limita el aumento de la biomasa [20]. Además de esta fase tectónica, ocurrió en el Cámbrico un movimiento importante de todas las placas tectónicas, de tal manera que la mayoría de éstas se fueron a parar en el trópico, lo que ayudó en la diversificación de los animales [21].
Para finalizar, cabe destacar que las temperaturas eran altas durante por lo menos parte del Cámbrico: con temperaturas de unos 20-25 °C, la superficie del mar a alta latitud geográfica (alrededor del círculo polar) era bastante más alta de lo que es actualmente. Estas “condiciones de invernadero” deben haber ayudado en el desarrollo de los animales [22].
Detonantes ecológicos
Entre las explicaciones ecológicas de la explosión cámbrica, la principal es la de la aparición de los carnívoros. Antes del Cámbrico no había carnívoros: los organismos se alimentaban tal vez de los restos de animales muertos, mas no de animales vivos. Esto cambió en el Cámbrico, cuando aparecieron los primeros depredadores, tales como una variedad de artrópodos (ver abajo). Esto fue posible gracias al aumento en oxígeno: se calculó que, para que pueda haber depredadores, la cantidad de oxígeno debe ser por lo menos 10% de la cantidad actual [23].
La aparición de los carnívoros causó en los animales el desarrollo de estrategias para evitar ser comido. Entre estas estrategias se encontraba la de tener una superficie externa dura, por ejemplo, una concha o un exoesqueleto. En el Ediacárico (el período anterior al Cámbrico; ver la entrega anterior) ya había algunos organismos con conchas, pero en el Cámbrico se volvieron comunes gracias a sus ventajas protectoras. Se ha determinado que la biomineralización, como se llama este proceso de formar partes duras, ocurrió de manera independiente y prácticamente contemporánea en distintos linajes de animales [24]. Al principio, los esqueletos protectores eran simples y el organismo no tuvo que invertir mucha energía en producirlos; sin embargo, a lo largo del Cámbrico se volvieron más elaborados y se utilizaron biominerales más resistentes, lo que refleja que aumentó la presión de los carnívoros, haciendo que una buena protección se hizo necesaria [25]. En efecto, la mayoría de los animales eran carnívoros (hoy en día, 63% de los animales lo son), y los primeros animales probablemente eran carnívoros también [26].
Entre los biominerales más comunes se encuentran varios tipos de carbonatos de calcio. El fenómeno de la biomineralización pudo darse debido al aumento de la cantidad de calcio, y también de fosfato, en el agua marina al inicio del Cámbrico, probablemente debido a una fase de actividad tectónica que causó erosión de rocas calcáreas en los continentes y por ende, influjo de calcio en el mar [27].
Un aumento en el tamaño de los animales puede haber sido causado por el desarrollo de intestinos más grandes, lo que resultó en un aumento del tamaño de los depredadores y, para mayor protección, también de sus presas [28].
Detonantes genéticos y de desarrollo
Desde el punto de vista genético, la explosión cámbrica se caracteriza por la aparición de muchos rasgos genéticos nuevos. Al analizar los genomas de animales actuales, se pudo determinar que en el Cámbrico aparecieron varios rasgos característicos de los animales [29]. Arriba ya se mencionó que apareció un mecanismo para detectar la cantidad de oxígeno. También se desarrolló un mecanismo para inducir unas condiciones de hipoxia (baja concentración de oxígeno) en las células madre, para que no se conviertan demasiado temprano en células de tejidos específicos; se ha sugerido que el desarrollo de este mecanismo puede haber sido un detonante genético de la explosión cámbrica [30].
Otra innovación biológica que cambió de manera fundamental los ecosistemas terrestres, es la aparición de la visión. Al desarrollarse los primeros ojos, en el Cámbrico, los organismos ganaron acceso a una manera completamente nueva de obtener información de su entorno. ¿Por qué se desarrolló la visión en aquel entonces? Pudiera estar relacionado a la aparición de los depredadores: éstos necesitarían ojos para ubicar sus presas, y las potenciales presas necesitaban ojos para enterarse de la presencia de los depredadores e intentar escapar a un lugar seguro [31].
El desarrollo de nuevas formas de organismos y nuevas funciones biológicas, en combinación con las nuevas redes ecológicas, pudiera explicar en gran medida la explosión cámbrica [32].
Entendimiento actual
De acuerdo a lo expuesto anteriormente, queda claro que no fue una sola la causa de la explosión cámbrica: más bien, se trató de una combinación de factores, en parte interconectados, que la hicieron posible. Factores externos actuaron como condiciones necesarias, pero factores internos, tales como cambios genéticos y ecológicos, impulsaron la radiación de los animales [33]. Tal vez, la explosión cámbrica fue un fenómeno que se dio de manera casi automática, cuando estuvieron dadas las condiciones necesarias: en este sentido, los procesos de la evolución son flexibles y se aprovechan de las oportunidades generadas [34]. De verlo así, inclusive se pudiera plantear que la explosión de los tipos de animales fue más la explotación de las condiciones nuevas por parte de animales que ya habían desarrollado las herramientas genéticas para aprovechar estos hábitats novedosos, en lugar de un cambio fundamental en la composición genética de los animales [35].

Los animales del Cámbrico
Los fósiles de los animales que vivieron en el Cámbrico se encuentran en afloramientos en muchas partes del mundo. Pero normalmente son sólo las partes duras de los organismos (conchas, esqueleto, etc.) las que se fosilizan: las partes blandas muy raramente quedan preservadas. Pero eso es justo lo que ocurrió en algunos lugares. Vimos en la entrega anterior como se conservaron los animales del Ediacárico, en aquel entonces invertebrados, o sea blandos, en algunos lugares donde se dieron las condiciones especiales para su conservación: Ediacara, algunos lugares en la China… También para el Cámbrico se conocen algunos lugares donde se encontraron grandes cantidades de animales y otros organismos, exquisitamente fosilizados, incluyendo sus partes blandas. En primer lugar: los esquistos de Burgess, en las Montañas Rocosas de Canadá, donde en 1909 se hizo el primer hallazgo de fósiles hasta ese entonces desconocidos, datados en 508 millones de años, y que sigue dando sorpresas. El paleontólogo estadounidense Stephen Jay Gould (1941-2002) escribió un libro muy ameno e interesante sobre los esquistos de Burgess y sus fósiles [36].
Posteriormente, se encontraron yacimientos de tipo Burgess en otras partes del mundo, notablemente en Australia [37] y la China. Recientemente fue descubierto el yacimiento de Qingjiang en el sur de la China, que con sus 518 millones de años de edad es más viejo que Burgess y tiene el potencial de proporcionar mucha información nueva sobre los animales de esos tiempos y la Explosión Cámbrica [38].
Mucho de lo que sabemos hoy en día de los animales del Cámbrico se debe a Burgess y yacimientos parecidos – pero no nos olvidemos de los afloramientos “tradicionales”, que siguen aportando fósiles desconocidos.
Tal como se mencionó al inicio de esta entrega, en el Cámbrico aparecieron varios filos (linajes) de animales, que hoy en día siguen existiendo [39]. Probablemente, el filo más importante fue el de los artrópodos, al que pertenecen por lo menos 80% de los animales conocidos. Los artrópodos, que incluyen, entre otros, a los crustáceos, los insectos y los arácnidos, se caracterizan por estar provistos de patas articuladas. En realidad, no son sólo las patas, sino todo el cuerpo el que está formado por varios segmentos unidos entre sí por medio de articulaciones [40].
El artrópodo emblemático del Cámbrico (y períodos sucesivos) era el trilobites (ver figura), caracterizado por tener tres partes bien definidas: cabeza, tórax y pigidio [41].
Los trilobites aparecieron hace 521 millones de años, y los primeros artrópodos (mejor dicho, las primeras trazas fósiles que se pueden atribuir a artrópodos) pueden tener una edad de 537 millones de años [42]. Los probables ancestros de los artrópodos son los lobopodios, un grupo de animales ahora extinto, que tenían el aspecto de gusanos con patas segmentadas [43]. El lobopodio Diania cactiformis (ver figura), cubierto por un exoesqueleto espinoso, puede ser un ancestro directo de los artrópodos [44].

Los depredadores más grandes de los mares cámbricos, en la cúspide de la pirámide alimenticia, eran los anomalocaris: artrópodos pertenecientes a un linaje distinto al de los artrópodos actuales, que alcanzaban una longitud de hasta un metro (ver figura) [45]. Hurdia, perteneciente a la misma familia pero más pequeño que Anomalocaris, se especializaba probablemente en presas más pequeñas, o tal vez era un carroñero [46]. Otros depredadores eran los artrópodos Habelia [47] (del tamaño de un camarón) y Cambroraster [48] – ambos encontrados en los esquistos de Burgess. Mollisonia era un artrópodo del tamaño de un pulgar; a pesar de su tamaño reducido, este primer ancestro conocido de los escorpiones y arácnidos era, con sus pinzas y ojos complejos, un gran depredador [49].

Pahvantia era un animal, relacionado a los artrópodos, que nadaba libremente en el mar. Era un filtrador, o sea, se alimentaba de organismos planctónicos suspendidos en el agua. Su tamaño de unos 24 centímetros era menos grande que el de los filtradores mayores, que alcanzaban los dos metros de longitud, pero al alimentarse – probablemente – de organismos en lugar de material orgánico, ocupaba una posición importante en la cadena alimenticia del mar [50]. El Cambroraster arriba mencionado pertenecía al mismo grupo que Pahvantia, los radiodontos, pero posiblemente filtraba sedimentos en busca de alimentos, no agua [51].
Al otro extremo estaban los gusanos, que se componen de distintos grupos de animales. Vivían en el fondo marino, algunos moviéndose por la superficie del fondo (tales como los gusanos de cerdas, que son anélidos [52]), otros excavando los sedimentos para alimentarse extrayendo materia orgánica. También había gusanos carnívoros, con mandíbulas [53] o probóscides (narices) reforzadas [54], que atacaban a sus presas desde sus madrigueras en el fondo marino. En las heces de algunos de estos gusanos carnívoros, que tenían una longitud de unos veinte centímetros, se ha encontrado restos de peces, trilobites y artrópodos, lo que indica que eran depredadores temibles [55].
Los gusanos, especialmente aquellos que removían el fondo marino, tenían un impacto importante sobre su entorno, al causar un reciclaje de la materia orgánica y elementos importantes para la vida (fósforo, nitrógeno, etc.) atrapados en los sedimentos del fondo marino; también aumentaban la cantidad de oxígeno disponible en ese ambiente, abriendo nichos para otros organismos [56], entre los que se encontraron los meiobenthos, diminutos animales de menos de un milímetro de longitud que viven entre los granos de arena del fondo marino [57]. Por otro lado, también se ha propuesto que la oxidación del material orgánico del fondo marino puede haber causado más bien una bajada de la cantidad de oxígeno en el mar y un aumento en la cantidad de dióxido de carbono, lo que pudiera haber contribuido al calentamiento global que ocurrió en el trascurso del Cámbrico [58].

También había gusanos que resultaron no ser invertebrados, sino vertebrados primitivos. En efecto, Pikaia, un animal en forma de anguila, con una longitud de unos cinco centímetros (ver imagen), tiene una primitiva notocorda (precursora de la columna vertebral). Es el vertebrado más viejo conocido y, por tanto, pudiera ser el ancestro de todos los vertebrados actuales, incluyendo a nosotros, los humanos [59]. Hoy en día, entre los descendientes más directos de Pikaia están las lampreas (parecidas a las anguilas [60]) y los anfioxos (con un aspecto comparable a un filete de anchoa [61]). Sus genomas incluyen grupos Hox (responsables de, entre otras cosas, el desarrollo y la forma del cuerpo) más antiguos que los grupos Hox de otros animales, lo que permite estudiar cómo la evolución de los animales ha ido de la mano de la evolución de los grupos Hox.
Otros vertebrados primitivos que aparecieron en el Cámbrico, eran los vetulícolas (ver imagen). Tenían una longitud de hasta unos 17 centímetros, se movían libremente en el mar y probablemente se alimentaban filtrando partículas orgánicas y/u organismos planctónicos del agua. No eran ancestros directos de los vertebrados actuales, pero su existencia apunta a una gran diversidad de vertebrados primitivos en el Cámbrico, de los que muchos linajes desaparecieron [62].

Desplazándonos hacia la raíz del árbol genealógico de los animales, encontramos animales que pudieran ser ancestros comunes entre los vertebrados y otros grupos, tales como los equinodermos (que incluyen, por ejemplo, a los erizos del mar). Se trata de organismos milimétricos, globulares, con una boca pero carente de ano, llamados Saccorhytus. Datan del inicio del Cámbrico, y aunque su forma no se parece mucho a la de los vertebrados, su edad coincide con la del ancestro putativo [63]. Otro animal globular sin tracto digestivo u órganos claros, pero con espinas milimétricas, es Nidelric, único representante de un grupo del que no sabemos nada más [64].
Unos cuantos fósiles del Cámbrico han sido asignados con cierta confianza a alguno de los grandes linajes de animales. Los hiolitos, por ejemplo, animales con una concha cónica tapada por un opérculo, y dos apéndices, pudieron ser clasificados como lofoferados: animales con tentáculos para alimentarse [65].

Sin embargo, quedan fósiles de los cuales se desconoce a qué grupo pertenecen. Entre estos organismos enigmáticos se encuentra Siphusauctum, un animal en forma de tulipán que vivía anclado al fondo marino [66]. Gould, en su libro sobre los esquistos de Burgess, menciona otros ejemplos curiosos de organismos no clasificados [67].
En cuanto a las novedades anatómicas, también hay que resaltar el desarrollo, en algunos artrópodos, del ojo compuesto, tal como existe todavía hoy en día en ciertos insectos, tales como las abejas [68]. Los primeros ojos ya habían aparecido en el Ediacárico (ver la entrega anterior), probablemente en el contexto de la aparición de los primeros depredadores [69], pero eran muy primitivos.
Probablemente, el desarrollo de los ojos iba de la mano del desarrollo del cerebro. El cerebro normalmente no se fosiliza, pero en el caso de un artrópodo cámbrico con ojos, Fuxianhuia, se encontraron restos del cerebro, el cual ya tenía una organización compleja, con lo que era mucho más sofisticado que los cerebros de animales anteriores [70].
No sabemos cómo era el comportamiento colectivo de los animales del Cámbrico. Pero hay un indicio, en la forma de un hallazgo que se hizo, de decenas de artrópodos parecidos a camarones, formando filas. Tal vez se trata de una migración colectiva, lo que indicaría un comportamiento complejo, ya al inicio del desarrollo de los animales [71].
¿Qué pasó con los animales del Ediacárico? ¿La primera extinción de masa?
Tal como vimos en la entrega anterior, ya hubo cierta proliferación de animales en el Ediacárico, el período anterior al Cámbrico. Sin embargo, la mayoría de estos animales (pero no todos [72]) desaparecieron cuando se dio la Explosión Cámbrica. Se considera la primera extinción de masa del Fanerozoico [73]. aunque en la realidad la transición del Ediacárico al Cámbrico puede haber sido menos abrupta de lo que se ha postulado [74].
Se ha propuesto varias razones por la desaparición de buena parte de la fauna de Ediacara al inicio del Cámbrico. Puede haber jugado un papel importante una fuerte reducción en la cantidad de oxígeno en el agua de los océanos, que ocurrió justo antes de que empezara el Cámbrico [75]. Pero otros indicios apuntan a una causa más bien ecológica: al tiempo que se produjera el inicio de la expansión cámbrica, declinaron las especies del Ediacárico tanto en cantidad de organismos como en diversidad, y al fin desaparecieron [76].
Conclusión
La Explosión Cámbrica marcó el inicio de los linajes de animales y de los ecosistemas como los conocemos en la actualidad, por lo menos en cuanto a los mares se refiere. La colonización de los continentes por parte de los animales aun no había empezado, pero por lo demás nuestro planeta empezó a parecerse a la tierra actual, también en términos de la cantidad de oxígeno, la temperatura etc., aunque seguiría dándose fluctuaciones importantes.
En esta entrega nos hemos enfocado hacia los animales, los protagonistas de la Explosión Cámbrica. Sin embargo, esta gran diversificación de los animales obviamente tuvo un impacto enorme sobre los otros tipos de organismos también: al alimentarse de otros organismos, incluyendo otros animales, los animales cambiaron definitivamente los ecosistemas, y todos los organismos tuvieron que adaptarse a esta nueva realidad. Esto resultó en grandes cambios evolutivos en todos los grupos de organismos, no sólo los animales [77].
Entre el final del Cámbrico y nuestros tiempos pasaron 485 millones de años. Durante este intervalo pasaron muchas cosas: aparecieron especies nuevas, desaparecieron otras (muchas durante alguna de las extinciones de masa), hubo períodos de glaciaciones, se formaron continentes nuevos… Pero la vida ya se había consolidado en la tierra. Por tanto, damos fin a esta serie de entregas sobre el desarrollo de la vida en nuestro planeta. En entregas futuras hablaremos de algunos aspectos específicos de la historia de la vida después del Cámbrico.
Nota: la imagen en el encabezado de esta entrega muestra unos trilobites gigantes (muchos miden más de 30cm de largo) del norte de Portugal. En el Museu das Trilobites, en Canelas-Arouca (Portugal), se encuentra una colección impresionante de estos trilobites gigantes únicos. Fuente: http://listadeaureus.blogspot.com/2009/05/trilobites-gigantes-en-portugal.html.
[1] Ver: https://es.wikipedia.org/wiki/Explosi%C3%B3n_c%C3%A1mbrica.
[2] Collins, A.G., 1994. Ver: https://ucmp.berkeley.edu/phyla/metazoafr.html.
[3] Maloof, A.C., Porter, S.M., Moore, J.L., Dudás, F.Ö., Bowring, S.A., Higgins, J.A., Fike, D.A. y Eddy, M.P., 2010. The earliest Cambrian record of animals and ocean geochemical change. GSA Bulletin, 122 (11-12), 1731-1774. https://doi.org/10.1130/B30346.1.
[4] Linnemann, U. y otros, 2018. New high‐resolution age data from the Ediacaran–Cambrian boundary indicate rapid, ecologically driven onset of the Cambrian explosion. Terra Nova, 31, 49-58. https://doi.org/10.1111/ter.12368.
[5] Deline, B., Greenwood, J.M., Clark, J.W., Puttick, M.N., Peterson, K.J. y Donoghue, P.C.J., 2018. Evolution of metazoan morphological disparity. Proceedings of the National Academy of Sciences, 115 (38), E8909-E8918. www.pnas.org/content/115/38/E8909.
[6] Lee, M.S.Y., Soubrier, J. y Edgecombe, G.D., 2013. Rates of phenotypic and genomic evolution during the Cambrian Explosion. Current Biology, 23 (19), 1889-1895. https://doi.org/10.1016/j.cub.2013.07.055.
[7] Budd, G.E., 2003. The Cambrian fossil record and the origin of the phyla. Integrative and Comparative Biology. 43 (1), 157-165. https://doi.org/10.1093/icb/43.1.157.
[8] Jermiin, L.S., Poladian, L. y Charleston, M.A., 2005. Is the «Big Bang» in animal evolution real? Science, 310 (5756), 1910-1911. https://science.sciencemag.org/content/sci/310/5756/1910.full.pdf.
[9] Rokas, A., Krüger, D. y Carroll, S.B., 2005. Animal evolution and the molecular signature of radiations compressed in time. Science, 310 (5756), 1933-1938. https://science.sciencemag.org/content/310/5756/1933.
[10] Smith, M.P. y Harper, D.A.T., 2013. Causes of the Cambrian Explosion. Science, 341 (6152), 1355-1356. https://science.sciencemag.org/content/341/6152/1355.
[11] Fike, D.A., Grotzinger, J.P., Pratt, L.M. y Summons, R.E., 2006. Oxidation of the Ediacaran ocean. Nature, 444, 744-747. www.nature.com/articles/nature05345. Canfield, D.E., Poulton, S.W. y Narbonne, G.M., 2007. Late-Neoproterozoic deep-ocean oxygenation and the rise of animal life. Science, 315 (5808), 92-95. https://science.sciencemag.org/content/315/5808/92.
[12] Gill, B.C., Lyons, T.W., Young, S.A., Kump, L.R., Knoll, A.H. y Saltzman, M.R., 2011. Geochemical evidence for widespread euxinia in the Later Cambrian ocean. Nature, 469, 80-83. www.nature.com/articles/nature09700.
[13] Wang, D. y otros, 2018. Coupling of ocean redox and animal evolution during the Ediacaran-Cambrian transition. Nature Communications, 9, 2575. www.nature.com/articles/s41467-018-04980-5.
[14] Lyons, T.W., Reinhard, C.T. y Planavsky, N.J., 2014. The rise of oxygen in Earth’s early ocean and atmosphere. Nature, 506, 307-315. www.nature.com/articles/nature13068.
[15] Erwin, D.H., Laflamme, M., Tweedt, S.M., Sperling, E.A., Pisani, D. y Peterson, K.J., 2011. The Cambrian Conundrum: early divergence and later ecological success in the early history of animals. Science, 334 (6059), 1091-1097. https://science.sciencemag.org/content/334/6059/1091.
[16] Saltzman, M.R., Young, S.A., Kump, L.R., Gill, B.C., Lyons, T.W. y Runnegar, B., 2011. Pulse of atmospheric oxygen during the late Cambrian. Proceedings of the National Academy of Sciences, 108 (10), 3876-3881. https://doi.org/10.1073/pnas.1011836108.
[17] Stigall, A.L., Edwards, C.T., Freeman, R.L. y Rasmussen, C.M.Ø., 2019. Coordinated biotic and abiotic change during the Great Ordovician Biodiversification Event: Darriwilian assembly of early Paleozoic building blocks. Palaeogeography, Palaeoclimatology, Palaeoecology, 530, 249-270. https://doi.org/10.1016/j.palaeo.2019.05.034.
[18] Loenarz, C., Coleman, M.L., Boleininger, A., Schierwater, B., Holland, P.W.H., Ratcliffe, P.J. y Schofield, C.J., 2011. The hypoxia‐inducible transcription factor pathway regulates oxygen sensing in the simplest animal, Trichoplax adhaerens. EMBO reports, 12, 63-70. https://doi.org/10.1038/embor.2010.170.
[19] Peters, S.E. y Gaines, R.R., 2012. Formation of the ‘Great Unconformity’ as a trigger for the Cambrian explosion. Nature, 484, 363-366. www.nature.com/articles/nature10969.
[20] Cook, P.J. y Shergold, J.H., 1984. Phosphorus, phosphorites and skeletal evolution at the Precambrian—Cambrian boundary. Nature, 308, 231-236. www.nature.com/articles/308231a0 Brasier, M.D. y Callow, R.H.T., 2007. Changes in the patterns of phosphatic preservation across the Proterozoic-Cambrian transition. Memoirs of the Association of Australasian Palaeontologists, 34, 20. https://search.informit.com.au/documentSummary;dn=219652132995816;res=IELHSS.
[21] Mitchell, R.N., Raub, T.D., Silva, S.C. y Kirschvink, J.L., 2015. Was the Cambrian explosion both an effect and an artifact of true polar wander? American Journal of Science, 315 (10), 945-957. www.ajsonline.org/content/315/10/945.abstract.
[22] Hearing, T.W. y otros, 2018. An early Cambrian greenhouse climate. Science Advances, 4 (5), eaar5690. https://advances.sciencemag.org/content/advances/4/5/eaar5690.full.pdf.
[23] Sperling, E.A., Knoll, A.H. y Girguis, P.R., 2015. The ecological physiology of Earth’s second oxygen revolution. Annual Review of Ecology, Evolution, and Systematics, 45, 215-235. https://doi.org/10.1146/annurev-ecolsys-110512-135808.
[24] Murdock, D.J.E. y Donoghue, P.C.J., 2011. Evolutionary origins of animal skeletal biomineralization. Cells Tissues Organs, 194, 98-102. https://doi.org/10.1159/000324245. Gilbert, P.U.P.A., Porter, S.M., Sun, C.-Y., Xiao, S., Gibson, B.M., Shenkar, N. y Knoll, A.H., 2019. Biomineralization by particle attachment in early animals. Proceedings of the National Academy of Sciences, en imprenta. https://doi.org/10.1073/pnas.1902273116.
[25] Wood, R. y Zhuravlev, A.Yu., 2012. Escalation and ecological selectively of mineralogy in the Cambrian Radiation of skeletons. Earth-Science Reviews, 115 (4), 249-261. https://doi.org/10.1016/j.earscirev.2012.10.002.
[26] Román‐Palacios, C., Scholl, J.P. y Wiens, J.J., 2019. Evolution of diet across the animal tree of life. Evolution Letters, 3 (4), 339-347. https://doi.org/10.1002/evl3.127.
[27] Brennan, S.T., Lowenstein, T.K. y Horita, J., 2004. Seawater chemistry and the advent of biocalcification. Geology, 32 (6), 473-476. https://doi.org/10.1130/G20251.1.
[28] Peterson, K.J., McPeek, M.A. y Evans, D.A.D., 2005. Tempo and mode of early animal evolution: inferences from rocks, hox, and molecular clocks. Paleobiology, 31 (2), 36-55. www.jstor.org/stable/25482668.
[29] Domazet-Lošo, T., Brajković, J. y Tautz, D., 2007. A phylostratigraphy approach to uncover the genomic history of major adaptations in metazoan lineages. Trends in Genetics, 23 (11), 533-539. https://doi.org/10.1016/j.tig.2007.08.014.
[30] Hammarlund, E.U., von Stedingk, K. y & Påhlman, S., 2018. Refined control of cell stemness allowed animal evolution in the oxic realm. Nature Ecology & Evolution, 2, 220-228. www.nature.com/articles/s41559-017-0410-5.
[31] Parker, A., 2003. In the blink of an eye. The Free Press (Simon & Schuster UK).
[32] Marshall, C.R., 2006. Explaining the Cambrian “explosion” of animals. Annual Review of Earth and Planetary Sciences, 34, 355-384. https://doi.org/10.1146/annurev.earth.33.031504.103001.
[33] Lowe, C.J., 2013. What led to metazoa’s Big Bang? Science, 340 (6137), 1170-1171. https://science.sciencemag.org/content/340/6137/1170.abstract. Smith y Harper, 2013. Ver nota 10.
[34] Conway Morris, S., 2006. Darwin’s dilemma: the realities of the Cambrian ‘explosion’. Philosophical Transactions of the Royal Society B, 361, 1069-1083. https://doi.org/10.1098/rstb.2006.1846.
[35] Bottjer, D.J., 2005. The early evolution of animals. Scientific American, Agosto 2005, 42-47. www.sciam.com.
[36] Gould, S.J., 1989. Wonderful life. The Burgess Shale and the nature of history. W.W. Norton & Company, Inc. Traducción al castellano: La vida maravillosa. Crítica. ISBN 978-84-7423-944-7.
[37] Ver: https://en.wikipedia.org/wiki/Emu_Bay_Shale.
[38] Fu, D. y otros, 2019. The Qingjiang biota—A Burgess Shale–type fossil Lagerstätte from the early Cambrian of South China. Science, 363 (6433), 1338-1342. https://science.sciencemag.org/content/363/6433/1338. Daley, A.C., 2019. A treasure trove of Cambrian fossils. Science, 363 (6433), 1284-1285. https://science.sciencemag.org/content/363/6433/1284.
[39] Ver: https://es.wikipedia.org/wiki/C%C3%A1mbrico.
[40] Ver: https://es.wikipedia.org/wiki/Arthropoda.
[41] Ver: https://es.wikipedia.org/wiki/Trilobita.
[42] Daley, A.C., Antcliffe, J.B., Drage, H.B. y Pates, S., 2018. Early fossil record of Euarthropoda and the Cambrian Explosion. Proceedings of the National Academy of Sciences, 115 (21), 5323-5331. www.pnas.org/content/115/21/5323.
[43] Ver: https://es.wikipedia.org/wiki/Lobopodia.
[44] Liu, J. y otros, 2011. An armoured Cambrian lobopodian from China with arthropod-like appendages. Nature, 470, 526-530. www.nature.com/articles/nature09704.
[45] Ver: https://es.wikipedia.org/wiki/Anomalocaris.
[46] Daley, A.C., Budd, G.E., Caron, J.-B., Edgecombe, G.D. y Collins, D., 2009. The Burgess Shale Anomalocaridid Hurdia and Its significance for early euarthropod evolution. Science, 323 (5921), 1597-1600. https://science.sciencemag.org/content/323/5921/1597.
[47] Aria, C. y Caron, J.-B., 2017. Mandibulate convergence in an armoured Cambrian stem chelicerate. BMC Evolutionary Biology, 17, 261. https://bmcevolbiol.biomedcentral.com/articles/10.1186/s12862-017-1088-7.
[48] Moysiuk, J. y Caron, J.-B., 2019. A new hurdiid radiodont from the Burgess Shale evinces the exploitation of Cambrian infaunal food sources. Proceedings of the Royal Society B, 286 (1908), 20191079. https://doi.org/10.1098/rspb.2019.1079.
[49] Aria, C. y Caron, J.-B., 2019. A middle Cambrian arthropod with chelicerae and proto-book gills. Nature. www.nature.com/articles/s41586-019-1525-4.
[50] Lerosey-Aubril, R. y Pates, S., 2018. New suspension-feeding radiodont suggests evolution of microplanktivory in Cambrian macronekton. Nature Communications, 9, 3774. www.nature.com/articles/s41467-018-06229-7.pdf.
[51] Moysiuk y Caron, 2019. Ver nota 48.
[52] Nanglu, K. y Caron, J.-B., 2017. A New Burgess Shale polychaete and the origin of the annelid head revisited. Current Biology, 28 (2), 319-326.E1. https://doi.org/10.1016/j.cub.2017.12.019.
[53] Vinther, J. y Parry, L.A., 2019. Bilateral jaw elements in Amiskwia sagittiformis bridge the morphological gap between gnathiferans and chaetognaths. Current Biology, 29 (5), 881-888.E1. https://doi.org/10.1016/j.cub.2019.01.052.
[54] Wills, M.A., Gerber, S., Ruta, M. y Hughes, M., 2012. The disparity of priapulid, archaeopriapulid and palaeoscolecidworms in the light of new data. Journal of Evolutionary Biology, 25 (10), 2056-2076. https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1420-9101.2012.02586.x.
[55] Kimmig, J. y Pratt, B.R., 2018. Coprolites in the Ravens Throat River lagerstätte of northwestern Canada: implications for the Middle Cambrian food web. Palaios, 33 (4), 125-140. https://doi.org/10.2110/palo.2017.038.
[56] Zhang, L.-J., Qi, Y.-A., Buatois, L.A., Mángano, M.G., Meng, Y. y Li, D., 2017. The impact of deep-tier burrow systems in sediment mixing and ecosystem engineering in early Cambrian carbonate settings. Scientific Reports, 7, 45773. www.nature.com/articles/srep45773.pdf.
[57] Harvey, T.H.P. y Butterfield, N.J., 2017. Exceptionally preserved Cambrian loriciferans and the early animal invasion of the meiobenthos. Nature Ecology & Evolution, 1, 0022. www.nature.com/articles/s41559-016-0022.
[58] Van de Velde, S., Mills, B.J.W., Meysman, F.J.R., Lenton, T.M. y Poulton, S.W., 2018. Early Palaeozoic ocean anoxia and global warming driven by the evolution of shallow burrowing. Nature Communications, 9, 2554. www.nature.com/articles/s41467-018-04973-4.
[59] Morris, S.C. y Caron, J.-B., 2012. Pikaia gracilens Walcott, a stem‐group chordate from the Middle Cambrian of British Columbia. Biological Reviews, 87 (2), 480-512. https://doi.org/10.1111/j.1469-185X.2012.00220.x.
[60] Mehta, T.K. y otros, 2013. Evidence for at least six Hox clusters in the Japanese lamprey (Lethenteron japonicum). Proceedings of the National Academy of Sciences, 110 (40), 16044-16049. www.pnas.org/content/110/40/16044.
[61] Acemel, R.D. y otros, 2016. A single three-dimensional chromatin compartment in amphioxus indicates a stepwise evolution of vertebrate Hox bimodal regulation. Nature Genetics, 48, 336-341. www.nature.com/articles/ng.3497. Ver también: https://elpais.com/elpais/2016/02/01/ciencia/1454352023_172264.html.
[62] García-Bellido, D.C., Lee, M.S.Y., Edgecombe, G.D., Jago, J.B., Gehling, J.G. y Paterson, J.R., 2014. A new vetulicolian from Australia and its bearing on the chordate affinities of an enigmatic Cambrian group. BMC Evolutionary Biology, 14, 214. https://bmcevolbiol.biomedcentral.com/articles/10.1186/s12862-014-0214-z.
[63] Han, J., Morris, S.C., Ou, Q., Shu, D. y Huang, H., 2017. Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). Nature, 542, 228-231. www.nature.com/articles/nature21072.
[64] Hou, X., Williams, M., Siveter, D.J., Siveter, D.J., Gabbott, S., Holwell, D. y Harvey, T.H.P., 2014. A chancelloriid-like metazoan from the early Cambrian Chengjiang Lagerstätte, China. Scientific Reports, 4, 7340. www.nature.com/articles/srep07340.
[65] Moysiuk, J., Smith, M.R. y Caron, J.-B., 2017. Hyoliths are Palaeozoic lophophorates. Nature, 541, 394-397. www.nature.com/articles/nature20804.
[66] O’Brien, L.J. y Caron, J.-B., 2012. A new stalked filter-feeder from the Middle Cambrian Burgess Shale, British Columbia, Canada. PLoS ONE, 7 (1), e29233. https://doi.org/10.1371/journal.pone.0029233.
[67] Gould, 1989. Ver nota 36.
[68] Schoenemann, B., Pärnaste, H. y Clarkson, E.N.K., 2017. Structure and function of a compound eye, more than half a billion years old. Proceedings of the National Academy of Sciences, 114 (51), 13489-13494. www.pnas.org/content/114/51/13489.
[69] Parker, A., 2003. In the blink of an eye: How vision kick-started the big bang of evolution. The Free Press, Simon & Schuster UK Ltd.
[70] Ma, X., Hou, X., Edgecombe, G.D. y Strausfeld, N.J., 2012. Complex brain and optic lobes in an early Cambrian arthropod. Nature, 490, 258-261. www.nature.com/articles/nature11495.
[71] Hou, X.-G., Siveter, D.J., Aldridge, R.J. y Siveter, D.J., 2008. Collective hehavior in an Early Cambrian arthropod. Science, 322 (5899), 224. https://science.sciencemag.org/content/322/5899/224.abstract.
[72] Hoyal Cuthill, J.F. y Han, J., 2018. Cambrian petalonamid Stromatoveris phylogenetically links Ediacaran biota to later animals. Palaeontology, 61 (6), 813-823. https://onlinelibrary.wiley.com/doi/full/10.1111/pala.12393.
[73] Laflamme, M., Darroch, S.A.F., Tweedt, S.M., Peterson, K.J. y Erwin, D.H., 2013. The end of the Ediacara biota: extinction, biotic replacement, or Cheshire Cat? Gondwana Research, 23 (2), 558-573. https://doi.org/10.1016/j.gr.2012.11.004. Darroch, S.A.F., Smith, E.F., Laflamme, M. y Erwin, D.H., 2018. Ediacaran extinction and Cambrian explosion. Trends in Ecology & Evolution, 33 (9), 653-663. https://doi.org/10.1016/j.tree.2018.06.003.
[74] Zhu, M., Zhuravlev, A.Y., Wood, R.A., Zhao, F. y Sukhov, S.S., 2017. A deep root for the Cambrian explosion: Implications of new bio- and chemostratigraphy from the Siberian Platform. Geology, 45 (5), 459-462. https://doi.org/10.1130/G38865.1. Wood, R.A., 2019. The rise of animals. Scientific American, junio 2019, 18-25. www.ScientificAmerican.com.
[75] Zhang, F. y otros, 2018. Extensive marine anoxia during the terminal Ediacaran Period. Science Advances, 4, eaan8983. https://advances.sciencemag.org/content/advances/4/6/eaan8983.full.pdf.
[76] Darroch, S.A.F. y otros, 2015. Biotic replacement and mass extinction of the Ediacara biota. Proceedings of the Royal Society B, 282 (1814), 20151003. https://doi.org/10.1098/rspb.2015.1003. Darroch, S.A.F., Boag, T.H., Racicot, R.A., Tweedt, S., Mason, S.J., Erwin, D.H. y Laflamme, M., 2016. A mixed Ediacaran-metazoan assemblage from the Zaris Sub-basin, Namibia. Palaeogeography, Palaeoclimatology, Palaeoecology, 459, 198-208. https://doi.org/10.1016/j.palaeo.2016.07.003.
[77] Butterfield, N.J., 2011. Animals and the invention of the Phanerozoic Earth system. Trends in Ecology and Evolution, 26 (2), 82-87. www.sciencedirect.com/science/article/pii/S0169534710002764.
