Cambia, todo cambia… y todo cambio está enmarcado, de una manera u otra, dentro de las leyes de la evolución. En el caso de la evolución biológica vemos como las especies aparecen, cambian, se transforman en otras especies, y desaparecen. Lo mismo ocurre en el ámbito humano, que no puede separarse de la evolución biológica. Pero, ¿cómo exactamente es este ritmo de la naturaleza, de la evolución? En este blog, dedicado al cambio, estamos hablando ampliamente de la evolución. En posts anteriores (25 enero y 28 febrero de 2015) hemos hablado de los procesos que rigen la aparición de nuevas especies, y acerca de qué hace que ciertas especies evolucionan con más facilidad que otras (9 septiembre 2016). Veamos ahora cuál es el ritmo de la aparición de especies nuevas, y de su posterior desaparición.
La intención es entender mejor cómo funciona la evolución. Pero lo que nos interesa también es la evolución en el ámbito humano, Los procesos evolutivos que rigen la evolución en la naturaleza, también aplican, de una manera u otra, a nosotros y a nuestra cultura. Consideremos pues, después de hablar de los sobresaltos en la evolución, cómo esto se traduce al acontecer humano.
Evolución biológica: ¿continua o episódica?
El ritmo de la evolución es uno de los grandes temas de la paleontología (la ciencia que estudia la historia de la vida terrestre a través de los fósiles). El estadounidense Stephen Jay Gould (1941-2002), uno de los grandes paleontólogos de los últimos tiempos, planteó la pregunta así: ¿Cuál es el tempo del cambio orgánico? ¿Procede de forma gradual de manera continua y sin prisas, o es episódica?[1]
La cuestión si la evolución procede de manera continua o episódica pudiera parecer bastante académica, pero sus implicaciones van más allá de la paleontología y la biología, extendiéndose a la filosofía y hasta la religión. En el siglo XIX hubo un debate acerca de esta cuestión entre dos grupos: los gradualistas y los catastrofistas[2]. Para entender la diferencia entre estos dos, volvamos la mirada hacia las rocas.
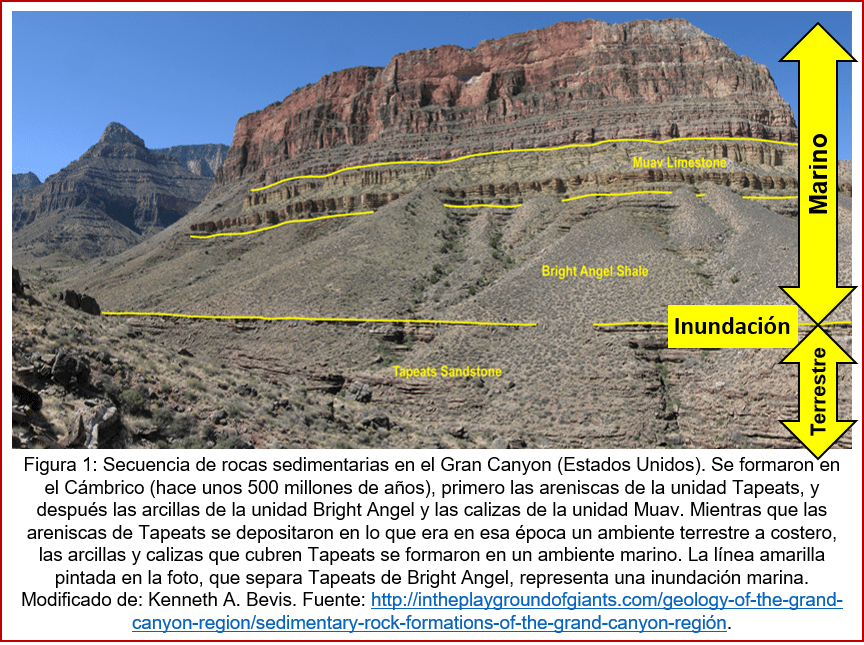
En la figura 1 se aprecia una de las paredes del Grand Canyon en los Estados Unidos. Se ve una secuencia de rocas sedimentarias (rocas formadas por sedimentación de arena, arcilla, etcétera, posteriormente endurecidas). Abajo se encuentran las rocas más viejas, las que primero se formaron: las areniscas de la unidad Tapeats. Por encima de estas se observan las arcillas de la unidad Bright Angel y las calizas de la unidad Muav, que se formaron después y por tanto son más jóvenes (pero todas son bastante viejas, al remontarse al Cámbrico, hace 500 millones de años). Mientras que las areniscas de Tapeats se depositaron en lo que era en esa época un ambiente terrestre a costero, las arcillas y calizas que cubren Tapeats se formaron en un ambiente marino. La línea amarilla pintada en la foto, que separa Tapeats de Bright Angel, representa una inundación marina. Así que la secuencia entera refleja un cambio en la geografía de la zona: inicialmente era una llanura fluvial y costera, que en algún momento se inundó y se convirtió en un mar. (Posteriormente, ya formadas las rocas, estas se levantaron y por esto encontramos en la montaña a rocas que se formaron en el mar.)
Ahora bien: los catastrofistas miraban tales secuencias de rocas y consideraron que la inundación marina debió haber sido un diluvio, o sea, un evento catastrófico. Concluyeron que a lo largo de la historia de la tierra debieron haberse producido no sólo uno, sino múltiples diluvios, parecidos al diluvio bíblico, de manera que donde antes había tierra y se formaron rocas terrestres, después del diluvio había mar y se formaron rocas marinas.
Los gradualistas o uniformistas, por otro lado, consideraron que la alternancia de rocas terrestres y marinas no tiene relación alguna con diluvios. Afirmaron que las subidas y bajadas del nivel del mar son un fenómeno recurrente y gradual en la historia de la tierra; de manera que no es necesario recurrir a eventos catastróficos para explicar las inundaciones marinas.
El debate entre estas dos visiones tenía claras connotaciones religiosas: los catastrofistas le dieron mucha importancia a la biblia como fuente de conocimiento, mientras que los uniformistas tenían un enfoque mucho más científico (y el debate sigue, ya que los creacionistas no se dan por vencidos a pesar de la abrumadora evidencia en contra de su punto de vista).
Uno de los campeones del uniformismo fue el geólogo inglés Charles Lyell (1797-1875), quien planteó que los procesos geológicos que, en épocas pasadas, causaron la formación de rocas y montañas son básicamente los mismos que están actuando hoy día, y que los cambios que ha experimentado la faz de la tierra han sido graduales y lentos, no episódicos y aun menos, catastróficos. Charles Darwin, el padre de la teoría de la evolución, se inspiró en esta visión de Lyell cuando afirmó que la evolución es gradual, y no catastrófica[3]. (Ver mis posts del 25 enero y 28 febrero de 2015 para una descripción de la selección natural según Darwin y de la evolución de las especies.)
Sin embargo, Darwin encontró un grave problema a la hora de intentar demonstrar que la evolución es un proceso gradual: la historia de las especies, tal como quedó escrita en las rocas, no muestra mucho gradualismo, y más bien sugiere que la evolución es discontinua. De hecho, antes de Darwin ya hubo un naturalista escocés, Patrick Matthew (1790-1874), quien hizo referencia a la selección natural como mecanismo de la aparición de especies nuevas, pero en un contexto de evolución episódica, discontinua[4]. Para demostrar que la evolución es gradual, Darwin necesitaba encontrar algún ejemplo de formas sucesivas de un organismo en rocas de edades sucesivas[5]. Si una especie “A” se convirtió en especie “B” en un proceso gradual, deberían encontrarse en las rocas fósiles de las formas intermedias. Desafortunadamente para Darwin, prácticamente nunca se encuentran tales formas intermedias.
La solución encontrada por Darwin para explicar esta falta de evidencia de una evolución gradual de las especies, fue suponer que las rocas que deberían contener las formas intermedias no están, o sea que los estratos en los cuales se encuentran los fósiles de la especie “B” fueron formados bastante tiempo después de los estratos en los cuales se halla la especie “A” aunque se encuentren directamente por encima de los mismos. Darwin llamó esta falta de tiempo entre estratos la “imperfección del historial geológico”[6].

La figura 2 ilustra esta situación, utilizando como ejemplo el foraminífero Globorotalia tumida, un organismo marino unicelular que tiene una concha calcárea. Este organismo apareció hace unos cinco millones de años, al inicio de una época geológica llamada el Plioceno, lo que se sabe porque se han hallado fósiles del mismo en estratos de esa edad, mas no en los estratos inmediatamente por debajo, que se formaron durante la época precedente, el Mioceno. En los estratos que se formaron durante el Mioceno se encuentran fósiles de Globorotalia plesiotumida, que se parece mucho a G. tumida, pero que tiene una forma un poco distinta y un menor tamaño. En los estratos que se formaron en el Plioceno ya no se encuentran fósiles de G. plesiotumida, así que se supone que esta especie evolucionó y se convirtió en G. tumida.
La figura 2A muestra cómo pudiera lucir esta situación en rocas de edad Mioceno a Plioceno. En los estratos del Mioceno encontraríamos sólo las conchas pequeñas de G. plesiotumida, y en los estratos del Plioceno sólo las conchas, más grandes, de G. tumida. En el límite entre las rocas del Mioceno y las del Plioceno observamos un salto.
¿Sería la evolución entonces un proceso saltacional, en lugar de gradual? Esto no es lo que Darwin consideró que ocurre: la evolución según Darwin es gradual. Por lo tanto, la explicación de Darwin del salto que acabamos de observar sería de suponer que transcurrió cierto tiempo entre la formación de las rocas del Mioceno y las del Plioceno. Durante este tiempo ocurrió, según la visión de Darwin, la transformación gradual de G. plesiotumida en G. tumida. Pero durante este período no ocurrió acumulación de sedimentos, o los sedimentos inicialmente acumulados fueron removidos, de manera que en las rocas no quedó representado el período en el cual ocurrió la transformación bajo consideración. Esto es lo que se ilustra en la figura 2B.
La realidad, sin embargo, fue distinta. Los fósiles fueron hallados no en un lugar cualquiera, sino en estratos en el fondo del Océano Índico. En el fondo de los océanos, lejos de los continentes, la acumulación de sedimentos tiende a ser lenta y continua, de manera que prácticamente toda la historia del océano está reflejada en los estratos. Lo que los investigadores[7] encontraron, no fue una falta de tiempo en el límite entre el Mioceno y el Plioceno, sino más bien una cantidad de globorotalias intermedias entre G. plesiotumida en G. tumida (ver la figura 2C). Estas globorotalias intermedias mostraron un aumento de tamaño rápido y repentino – bueno, rápido en términos geológicos: el cambio tomó unos cientos de miles de años. Ahora sabemos que lo que ocurrió en ese momento es una bifurcación: también apareció otra forma de globorotalia, pero al parecer esta volvió a desaparecer rápidamente[8].
De esta manera se obtuvo la siguiente visión: las globorotalias se mantuvieron sin cambios durante unos millones de años, para cambiar abruptamente y después volver a un estado de inmutabilidad. La evolución de esta especie procedió con sobresaltos: períodos largos de relativa inmutabilidad, de estasis evolutiva, interrumpidos por períodos cortos de cambios y de especiación, o sea, la aparición de especies nuevas. Esto es lo que Gould y el también paleontólogo Niles Eldredge denominaron equilibrios puntuados (punctuated equilibria), es decir interrumpidos[9].
En el caso de muchas especies, su evolución parece ser puntuada. Sólo en una minoría de especies (por ejemplo, organismos marinos planctónicos) la evolución suele ser gradual[10].
A nivel molecular (o sea, de los procesos bioquímicos que ocurren dentro del organismo), la inmutabilidad de los organismos se denomina homeostasis. Durante períodos de homeostasis, los mecanismos que mantienen la integridad de las células son capaces de contrarrestar los pequeños cambios que se pueden dar en el organismo a raíz de mutaciones genéticas. Pero al cabo de cierto tiempo, cuando se acumulan muchos cambios pequeños, o cuando ocurre un cambio en el entorno en el que vive el organismo, estos mecanismos conservadores ya no son capaces de contener los cambios en el organismo y se da un evento de evolución abrupta[11]. Es de notar que los organismos que acumulan más mutaciones no son necesariamente los que más rápidamente dan origen a nuevas especies[12].
Así que la evolución no es tan gradual como lo quisiera Darwin – pero tampoco es catastrófica. Más bien se puede afirmar que es discontinua: ocurre mediante cambios episódicos abruptos, separados por períodos de pocas modificaciones. Esto no invalida de ninguna manera el darwinismo en general: sólo nos indica que la evolución no es un proceso tan gradual como inicialmente se consideraba. Gould mismo indica, en respuesta a la pregunta que hizo al inicio de este post, que además hay que considerar el nivel: mientras que al nivel de la especie la evolución puede ser episódica, al nivel de población (un grupo de individuos dentro de una especie) la evolución pudiera ser más gradual[13].
Los episodios de cambio pueden estar relacionados con variaciones en el entorno, por ejemplo climáticas. En un estudio de ostrácodos (una clase de crustáceos marinos milimétricos) se encontró una relación estrecha entre eventos de especiación y cambios climáticos[14]. Pero a menudo una relación de este tipo no es obvia.
Tampoco es necesario que ocurran cambios durante el período de existencia de una especie: hay ejemplos de especies que se quedaron inmutables por millones de años, al parecer por estar suficientemente bien adaptados. En el post del 9 septiembre 2016 mencioné el pez celacanto, un fósil viviente proveniente del Cretácico, que se creyó extinto hasta que se descubrió el primer celacanto contemporáneo en 1938, en el Océano Índico.
Todo esto nos proporciona una nueva visión de los tiempos de la evolución. Entre otras cosas, se fortalece la importancia de la especie. Según la teoría de la evolución por selección natural (o sea, la de Darwin), los procesos evolutivos se desarrollan dentro de poblaciones de individuos. Pero si ocurren períodos de inmutabilidad de lo que claramente se puede identificar como una especie, tal vez haya un nivel jerárquico superior al de la población, el de la especie, en el que la selección natural no tiene el mismo impacto que en una población. Al nivel de la especie puede ocurrir selección natural también, inclusive con especies compitiendo entre sí, yendo más allá de la competición entre individuos. Esta selección de especies, postulada en 1975 por el biólogo y paleontólogo estadounidense Steven Stanley[15], dio origen a un intenso debate[16] (también porque el concepto de “especies” no está tan bien definido como se desearía[17]), pero ahora está siendo aceptada, de una forma u otra, por muchos biólogos, incluyendo algunos de renombre tales como el mismo Gould[18], y el gran naturalista alemán-americano, Ernst Mayr[19].
¿Cuán discontinua es la historia humana?
Tal como la evolución biológica, también la humana. La historia humana a veces se desarrolla de manera gradual, y otras veces de manera episódica, mostrando tanto elementos de continuidad como de discontinuidad (ver mis posts del 19 diciembre 2015 y 30 enero 2016 para algunos ejemplos). A menudo depende del enfoque del historiador cuáles elementos se consideran más relevantes. Carlo Marx, por ejemplo, consideró que la historia humana, así como la evolución biológica, ocurrió de forma discontinua. Otros, tales como el filósofo Aristóteles, enfatizaron la naturaleza gradual de los cambios en el acontecer humano. Probablemente tienen razón ambos, aunque fuera parcialmente: la historia humana muestra cómo, mientras que algunos cambios son discontinuos (por ejemplo las revoluciones varias), otros son graduales[20].
En términos generales, los cambios en la sociedad humana tienen esta misma característica: ciertos cambios son graduales, otros abruptos. Algunos sociólogos son muy claros en sus opiniones; Kenneth Bock, por ejemplo, escribe “lejos de ser unilinear, gradualmente progresivo, e inevitable, el cambio social es un fenómeno raro, el resultado de eventos específicos. Cuando se da un cambio, se da rápidamente. Por la mayor parte, la historia es ausencia de cambio, a menos que, y hasta que, algo ocurra”[21].
Radiación
La aparición de nuevas especies es, entonces, a menudo un acontecimiento bastante abrupto, en lugar de ser un proceso gradual. Y, una vez aparecida, una especie tiende a mantenerse más o menos estable, sin experimentar cambios mayores, hasta su desaparición. Estas son las dos bases de la teoría de los equilibrios puntuados de Eldredge y Gould[22].
Yendo un poco más allá, Gould aseveró[23] que la aparición de nuevas especies no sólo es bastante abrupta, sino que además hay eventos en los cuales aparecen, más o menos contemporáneamente, múltiples especies nuevas a partir de una especie ancestral. Este fenómeno de apariciones múltiples, Gould lo llama “diversificación”; otros lo llaman “radiación”. El proceso se ilustra en la figura 3, la cual muestra un árbol genealógico hipotético. La especie “A” da origen a múltiples otras especies en un período de tiempo breve: esto es la radiación.
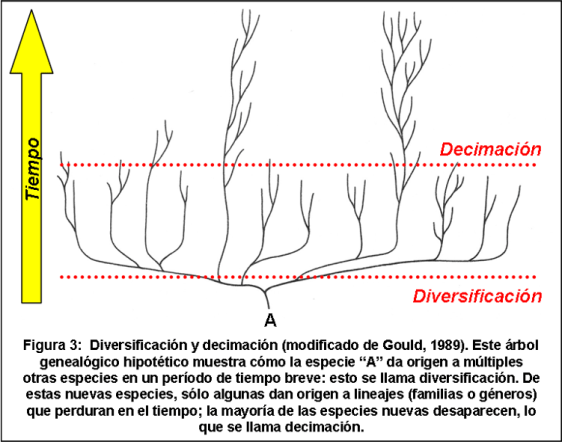
Las especies nuevas que aparecen en una radiación, se originan todas de la especie inicial. Al principio las especies nuevas pueden parecerse[24], en alimentación y/o conducta, lo que resulta en una competencia y por ende, mayor presión evolutiva, hasta que se dé una divergencia y alguna de las especies dé origen a una especie nueva, con otra conducta o fuente de alimentación. Así pueden aparecer muchas especies nuevas en poco tiempo, produciéndose una radiación adaptativa[25].
La causa de la radiación es generalmente el abrirse de un abanico de nuevos nichos ecológicos. Ejemplos de esto son los siguientes casos[26]:
- Una especie coloniza un área aislada cuyo ecosistema contiene pocas otras especies. Esto abre la posibilidad a la especie colonizadora de diversificarse, adaptándose a nuevos ambientes, en un proceso de especiación intensa. Por ejemplo, una isla o un lago. Radiaciones famosas son la de los pinzones de las islas Galápagos, descritas ya por el mismo Darwin (ver mi post del 28 febrero 2015), y la de los cíclidos[27], una familia de peces en los lagos de África oriental de los que hablaremos en un post futuro.
- La recolonización de un área empobrecida de especies después de un evento de extinción masiva. Esto crea unas oportunidades de especiación (formación de una nueva especie) similares a las descritas en el punto anterior[28]. Esto ocurrió, por ejemplo, después de la extinción masiva que causó la desaparición de los dinosaurios y marcó el final del Cretácico, hace 65 millones de años, cuando colapsaron ecosistemas enteros y hubo que volver a construirlos[29]. Grupos de animales que experimentaron una importante diversificación después de esta extinción, incluyen las aves[30] y los anfibios[31].
- La aparición de una nueva fuente de alimentación. Como ejemplo se puede citar los caballos, que empezaron a tener su auge en el Mioceno cuando cambió el clima y aparecieron grandes extensiones de estepas[32].
- Una innovación evolutiva que le da a una especie acceso a nuevos recursos. Por ejemplo, cuando el antecesor de los murciélagos desarrolló la capacidad de volar, aparecieron pronto muchas especies de murciélagos[33]. En el reino vegetal existe un ejemplo clásico: la aparición y diversificación explosiva, en el Cretácico (hace unos 80 millones de años), de las flores[34]. Las plantas y los árboles que florecen (las angiospermas) tuvieron mucho éxito tan pronto como aparecieron. Los rósidos, por ejemplo – importantes representantes de las angiospermas, que incluyen muchos de los frutales actuales –, tuvieron una importante fase de radiación en un período de, tal vez, no más de cuatro o cinco millones de años[35]. Durante esta diversificación nacieron múltiples familias nuevas, cada una con sus respectivas especies. Por cierto, estas nuevas especies formaron bosques extensos, los cuales a su vez permitieron el desarrollo de nuevas especies animales, entre los cuales especies de anfibios, hormigas y mamíferos.
También hubo eventos de radiación al inicio de la historia de los principales grupos de organismos: los metazoos (animales), por ejemplo, aparecieron hace algo más de 530 millones de años con una radiación importante que incluye lo que se denomina la “explosión cámbrica”[36]. Algo parecido pasó cuando los animales empezaron a colonizar los continentes a finales del Carbonífero (hace 300 millones de años) [37]. Los hongos tuvieron su radiación inicial también[38].
Generalmente, una radiación empieza con un aumento rápido en la cantidad de especies. (Sin embargo, esto no ocurre siempre: en ciertas radiaciones de especies terrestres el aumento en la cantidad de especies ocurrió en varios pulsos de diversificación moderada[39].) Después, cuando los nichos ecológicos disponibles empiezan a llenarse, se reduce considerablemente el ritmo con el que aparecen especies nuevas[40].
No es necesario que haya una separación física para que se desarrollen especies nuevas: cambio en conducta o hasta en coloración pueden separar poblaciones y resultar en especies distintas[41]. Especies parecidas que ocurren en la misma área geográfica pueden empezar a diferenciarse mediante el proceso de desplazamiento de caracteres, resultando en la formación de especies nuevas[42].
La diversificación de especies en el proceso de radiación puede ser de dos tipos: puede ser en términos de adaptación a muchos nichos ecológicos distintos; por ejemplo, peces que se diversifican adaptándose a aguas someras, o profundas, o túrbidas, etc. Esto se llama una radiación adaptativa – el tipo de radiación más común. Pero también pueden darse radiaciones en la que las nuevas especies exhiben una gran variedad de formas, pero básicamente dentro del mismo nicho ecológico. Estas se llaman radiaciones no adaptativas. El ejemplo clásico de este tipo de radiación es el de Albinaria, un género de caracoles en Grecia, que cuenta con muchas especies pero básicamente en el mismo ambiente[43].
Tal como ya vimos, las radiaciones son, por lo general, el resultado de la aparición de una oportunidad de entrar en nuevos nichos ecológicos. Pero lo opuesto no es válido: no siempre cuando aparecen nuevos nichos ecológicos, ocurren radiaciones[44]. Si se da una radiación, y cómo se desarrolla, no sólo depende de las condiciones ecológicas y ambientales, sino también de las características de la especie fundadora, o sea la especie ancestral a partir de la cual se da la diversificación y la aparición de especies nuevas. Si la capacidad de evolucionar de una especie es limitada, difícilmente puede generar una radiación adaptativa, aunque las condiciones ecológicas sean óptimas (ver mi post del 9 septiembre 2016). Lo mismo ocurre en el caso de especies no especializadas, adaptadas para vivir en ambientes diversos: la aparición de nuevos nichos ecológicos no necesariamente causará una diversificación de tales especies generalistas[45].
Los efectos de una diversificación van más allá de las especies que la experimentan: también afectan a otras especies en su alrededor. Esto ocurre especialmente en el caso de especies vinculadas entre sí, por ejemplo una especie que sirve de alimento a otra. Cuando cambia una, cambiará también la otra. Esto se llama coevolución, un fenómeno observado entre otros casos en la interacción entre plantas e insectos[46]. Cuando se diversificaron, en el Mioceno, los Phytomyza (un género de plantas que producen substancias químicas, tales como el látex, para defenderse de herbívoros), esta diversificación implicó una ampliación del abanico de defensas químicas y por tanto se diversificaron también los insectos que comen sus hojas[47].
Cabe destacar que la estrategia de diversificación de las defensas no siempre es exitosa. Las asclepias o algodoncillos desarrollaron inicialmente químicos para impedir ser comidas por insectos, y también hojas peludas con el mismo fin. Pero en ambos casos los insectos desarrollaron estrategias que neutralizan las defensas. Entonces, las asclepias dejaron de invertir en estas defensas costosas y poco eficaces; en su lugar, desarrollaron mecanismos para un crecimiento más rápido de sus hojas, reemplazando rápidamente las hojas comidas por los insectos[48].
Decimación
En algún momento después de la diversificación, llega la decimación. Esta es la fase de la poda. De las especies nuevas que aparecieron durante la fase de diversificación, unas cuantas no logran mantenerse y desaparecen. Son las perdedoras en la lucha por la sobrevivencia. Esto se puede deber a una competencia muy fuerte de otras especies, incluyendo a especies hermanas creadas en la misma radiación, o a algún cambio ambiental al cual no lograron adaptarse[49]. Tal como se muestra en la figura 3, la decimación ocurre cuando muchas de las especies nuevas desaparecen. El declino puede ocurrir en términos de la cantidad de especies y/o de la variedad de formas[50].
He aquí algunos ejemplos de decimación después de una fase de diversificación:
- Los caballos tuvieron dos fases de radiación, ambas seguidas por una decimación. La primera radiación ocurrió en el Eoceno (hace 55 millones de años), cuando dentro de un par de millones de años aparecieran media docena de géneros de esta, entonces nueva, familia – sólo para sufrir una posterior decimación que hizo desaparecer todos estos géneros menos uno. La segunda radiación ocurrió en el Mioceno, hace unos 20 millones de años: al cambiar la vegetación en grandes partes de Eurasia y Norteamérica de bosque a pradera, los caballos se adaptaron a aquel nuevo ambiente y esa nueva fuente de alimentación, el pasto, y experimentaron otra fuerte radiación. Esta fue seguida por la segunda decimación, hace unos cinco millones de años, cuando – tal vez debido a la fuerte competencia entre los herbívoros – desaparecieron todos los géneros de caballos menos Equus, el único género que existe en la actualidad y al que pertenecen el caballo, la cebra, y los asnos[51].
- Los simios experimentaron un gran auge en el período de tiempo denominado el Mioceno, desde hace unos 22 de millones de años[52]. Ocurrió una importante diversificación a raíz de la extensión del área geográfica de los simios: se abrió un paso entre África y Eurasia, por el Medio Oriente, y los simios pudieron colonizar a las selvas tropicales del sur de Europa y el sur y sureste asiático. Esta colonización hizo disparar la cantidad de especies de simios, hasta por lo menos unas cien. Después de esta diversificación, sin embargo, ocurrió la decimación: cuando – a finales del Mioceno, hace unos nueve a seis millones de años – el clima se volvió más frio y las selvas tropicales de Eurasia empezaron a desaparecer, desaparecieron también la mayoría de las especies de simios. Se piensa que sólo dos géneros de simios hayan sobrevivido a esta decimación: Sivapithecus en el sureste asiático (probablemente el antecesor del orangután actual), y Dryopithecus en el sur de Europa (que logró migrar hacia la selva africana, dando origen a otro importante grupo de primates).
- Este importante nuevo grupo de primates incluye no sólo a los gorilas y chimpancés de hoy día, sino también al género humano. Después de la migración de Dryopithecus hacia África, tuvo lugar en ese continente una diversificación que tal vez no fue tan espectacular, pero sí muy importante para nosotros. Véase la figura 4, la cual muestra cómo, hace unos siete millones de años, originaran distintas especies de primates a partir de un ancestro común (algún descendiente de Dryopithecus). Esta diversificación hizo aparecer varios géneros nuevos, tales como Sahelanthropus (un homínido antiguo hallado en Chad), Pan (el linaje de los chimpancés y bonobos, nuestros familiares más cercanos en el reino animal), y Ardipithecus (nuestros probables ancestros). Sin duda aparecieron unas cuantas especies más, cuya existencia desconocemos.

Diversificación y decimación cultural
En el ámbito cultural, o sea de los modos de vida, las costumbres, el lenguaje y los inventos humanos, ocurren también fases de diversificación y de decimación.
Las sociedades humanas tienen ciertas semejanzas con las especies biológicas, siendo capaces de evolucionar y adaptarse, y de desaparecer si no logran sobrellevar a su entorno. Por lo tanto es de esperar que diversificación y decimación ocurran también en sociedades humanas. De hecho, estudios antropológicos de antiguas sociedades en el oeste de los Estados Unidos indican que esto ocurrió[53]. La figura 5, por ejemplo, muestra cómo en el noroeste de los actuales Estados Unidos ocurrió una diversificación de las sociedades hace aproximadamente 5300 años: antes de ese momento vivieron allí sólo tribus de cazadores-recolectores móviles, mientras que después, cuando el clima se volvió más cálido, aparecieron también tribus más sedentarias. Hace unos 3800 años, cuando el clima se hizo más frío, desaparecieron estos distintos tipos de sociedades, y sólo se mantuvo una: tribus de colectores que durante los meses fríos se quedaron en sus pueblos y sólo salieron de allá en los meses más calientes.

El fenómeno de diversificación y decimación no se limita a las sociedades: tal como ya asomó el mismo Gould en uno de sus libros, en el caso de la tecnología humana se da también. A continuación dos ejemplos:
- La historia de la aeronáutica. Después del 1903, cuando lo hermanos Wright realizaron el primer vuelo en un avión con piloto, aparecieron rápidamente una gran cantidad de modelos de aviones distintos: monoplanos, biplanos, triplanos (por ejemplo el avión Fokker del piloto alemán von Richthofen, conocido como el Barón Rojo), y aviones con alas giratorias en lugar de fijas (tales como el autogiro, inventado en 1923 por el ingeniero español Juan de la Cierva – ver el encabezado de este post). Después de esta fase de diversificación ocurrió, inevitablemente, una decimación: desaparecieron los triplanos y casi todos los biplanos, así como los aviones con alas giratorias, quedándose prácticamente sólo los monoplanos. Éstos resultaron ser el modelo más apropiado para transportes aéreos rápidos, seguros y económicos.
- Los casetes de video. En los años setenta se desarrolló el casete como medio para grabar, de forma analógica, video y audio. En un lapso de algunos años aparecieron tres sistemas: primero el Betamax (de Sony), seguido por el VHS de JVC (Panasonic), y por último el Video 2000 de Philips y Grundig. A los pocos años después de esta radiación ocurrió la decimación: el Video 2000 desapareció antes del final de los años ochenta, y el Betamax una década después: VHS ganó la lucha por la supervivencia, por ser un sistema superior no tanto técnica, sino comercialmente.
Estos son sólo algunos ejemplos de diversificación y decimación en la cultura humana. Pero existen muchos más.
Conclusión
En muchos casos, tanto en la evolución biológica como la cultural, se dan episodios en los cuales aparecen en poco tiempo una variedad de especies a partir de una especie antecesora, o de inventos a raíz de un concepto. Estos episodios de diversificación son seguidos por fases de decimación, cuando desaparecen muchas de las especies nuevas y modelos nuevos por no poder competir.
A lo largo de la historia ha habido – y seguirá habiendo – una alternancia de fases de creación y destrucción. Construir y destruir son caras de la misma medalla: tanto en la evolución de los organismos biológicos como en la de las culturas humanas.
Este post es una versión actualizada de dos posts que publiqué en mi blog, ahora cerrado, “Los tiempos del cambio”.
Nota: la imagen en el encabezado del post muestra un autogiro (avió sin alas) del ingeniero español Juan de la Cierva, sobrevolando Valencia (España), en los años ‘30. Fuente: www.ocesaronada.net/juan-de-la-cierva-a-la-cuarta-la-vencida.
[1] Gould, S.J., 1977. Eternal metaphors of palaeontology. En: A. Hallam (editor), Patterns of evolution as illustrated by the fossil record; pág. 1-26. Developments in Palaeontology and Stratigraphy, 5. Elsevier.
[2] Bowler, P.J., 1983/1989. Evolution. The history of an idea; págs. 12-13. University of California Press.
[3] Bowler 1983/1989, págs. 21-22 (ver nota 2).
[4] Rampino, M.R., 2011. Darwin’s error? Patrick Matthew and the catastrophic nature of the geologic record. Historical Biology, 23 (2-3), 227-230. www.tandfonline.com/doi/full/10.1080/08912963.2010.523948. Sutton, M., 2015. On knowledge contamination: new data challenges claims of Darwin’s and Wallace’s independent conceptions of Matthew’s prior-published hypothesis. Filozoficzne Aspekty Genezy, 12, 167-205. www.ceeol.com/search/article-detail?id=354744.
[5] Esto es el dominio de la estratigrafía, una de las disciplinas de la geología. La estratigrafía estudia las capas de rocas sedimentarias (o sea, los estratos), que se forman, una por encima de la anterior, por la acumulación de sedimentos (arena, arcilla, conchas etcétera) en los mares, las costas, los lagos y las llanuras. Los estratos generalmente contienen fósiles (restos petrificados de organismos), y puesto que cada época tuvo sus propios organismos típicos, los fósiles permiten determinar la edad de los estratos. Si una especie “A” evolviéndose se convirtió en especie “B”, los estratos contentivos de los fósiles de la especie “B” se encontrarán justo por encima de los estratos que contienen la especie “A”.
[6] Darwin, Ch., 1859/1968. The origin of species by means of natural selection. Penguin Books, Londres. Cap. IX: On the imperfection of the geological record.
[7] Malmgren, B.A., Berggren, W.A. y Lohmann, G.P., 1983. Evidence for punctuated gradualism in the Late Neogene Globorotalia tumida lineage of planktonic foraminifera. Paleobiology, 9 (4), 377-389. www.jstor.org/stable/2400580.
[8] Hull, P.M. y Norris, R.D., 2010. Evidence for abrupt speciation in a classic case of gradual evolution. Proceedings National Academy of Sciences, 106 (50), 21224-21229. www.pnas.org/content/106/50/21224.full.pdf.
[9] Eldredge, N. y Gould, S.J., 1972. Punctuated equilibria: an alternative to phyletic gradualism. En: T.J.M. Schopf (ed.), Models in paleobiology; págs. 82-115. Freeman, Cooper & Co., San Francisco. www.somosbacteriasyvirus.com/phyletic.pdf. Gould, S.J. y Eldredge, N., 1993. Punctuated equilibrium comes of age. Nature, 366, 223 – 227. www.nature.com/nature/journal/v366/n6452/abs/366223a0.html.
[10] Benton, M.J. y Pearson, P.N., 2001. Speciation in the fossil record. TRENDS in Ecology & Evolution, 16 (7), 405-411. www.cell.com/trends/ecology-evolution/fulltext/S0169-5347(01)02149-8.
[11] Maresca, B. y Schwartz, J.H., 2006. Sudden origins: a general mechanism of evolution based on stress protein concentration and rapid environmental change. The Anatomical Record (Part B: New Anat.), 289B, 38-46. http://onlinelibrary.wiley.com/doi/10.1002/ar.b.20089/epdf.
[12] De Vargas, C. y Pawlowski, J., 1998. Molecular versus taxonomic rates of evolution in planktonic foraminifera. Molecular Phylogenetics and Evolution, 9 (3), 463-469. www.sciencedirect.com/science/article/pii/S1055790398904912.
[13] Gould 1977. Ver nota 1.
[14] Cronin, T.M., 1985. Speciation and stasis in marine ostracoda: climatic modulation of evolution. Science, 227, 60-63. http://science.sciencemag.org/content/227/4682/60.
[15] Stanley, S.M., 1975. A theory of evolution above the species level. Proceedings National Academy of Sciences, 72 (2), 646-650. www.pnas.org/content/72/2/646.full.pdf.
[16] Mayr, E., 1997. The objects of selection. Proceedings National Academy of Sciences, 94 (6), 2091-2094. www.pnas.org/content/94/6/2091.full.pdf. Simpson, C., 2016. The case for species selection. En preparación. http://biorxiv.org/content/early/2016/10/28/084046.
[17] Hey, J., 2001. The mind of the species problem. TRENDS in Ecology & Evolution, 16 (7), 326-329. www.cell.com/trends/ecology-evolution/fulltext/S0169-5347(01)02145-0. Ver también mi post del 28 febrero 2015.
[18] Lieberman, B.S. y Vrba, E.S., 2005. Stephen Jay Gould on species selection: 30 years of insight. Paleobiology, 31 (sp5), 113-121. www.bioone.org/doi/abs/10.1666/0094-8373%282005%29031%5B0113%3ASJGOSS%5D2.0.CO%3B2.
[19] Mayr, E., 1989. Speciational evolution or punctuated equilibria. Journal of Social and Biological Structures, 12 (2-3), 137-158. www.sciencedirect.com/science/article/pii/0140175089900419.
[20] Masters, R.D., 1992. Gradualism and discontinuous change in evolutionary biology and political philosophy. En: A. Somit y S.A. Peterson (eds.), The dynamics of evolution. The punctuated equilibrium debate in the natural and social sciences; págs. 282-319. Cornell University Press, Ithaca-London.
[21] “Far from being unilinear, graded progressive, and inevitable, social change is a rare phenomenon, the result of specific events. When change happens, it happens quickly. For the most part, history is nonchange unless and until something happens.” Bock 1980, citado en: Schubert, G., 1992. Catastrophe theory, evolutionary extinction, and revolutionary politics. En: A. Somit y S.A. Peterson (eds.), The dynamics of evolution. The punctuated equilibrium debate in the natural and social sciences; págs. 248-281. Cornell University Press, Ithaca-London.
[22] Eldredge, N. y Gould, S.J., 1972. Punctuated equilibria: an alternative to phyletic gradualism. En: T.J.M. Schopf (ed.), Models in paleobiology; págs. 82-115. Freeman, Cooper & Co., San Francisco.
[23] Gould, S.J., 1989. Wonderful life. The Burgess shale and the nature of history. Norton & Co., New York.
[24] Tobias, J.A., Cornwallis, C.K., Derryberry, E.P., Claramunt, S., Brumfield, R.T. y Seddon, N., 2014. Species coexistence and the dynamics of phenotypic evolution in adaptive radiation. Nature, 506, 359-363. www.nature.com/nature/journal/v506/n7488/full/nature12874.html.
[25] Schluter, D., 2003. Frequency dependent natural selection during character displacement in sticklebacks. Evolution, 57 (5), 1142-1150. www.bioone.org/doi/abs/10.1554/0014-3820(2003)057%5B1142:FDNSDC%5D2.0.CO%3B2.
[26] Losos, J.B. y Mahler, D.L., 2010. Adaptive radiation: the interaction of ecological opportunity, adaptation, and speciation. En: M.A. Bell y otros (eds.), Evolution since Darwin; págs. 381-420. Oxford University Press. https://global.oup.com/ushe/product/evolution-since-darwin-9780878934133?cc=es&lang=en&.
[27] Ver: https://es.wikipedia.org/wiki/Cichlidae.
[28] Erwin, D.H., 2001. Lessons from the past: Biotic recoveries from mass extinctions. Proceedings National Academy of Sciences, 98 (10), 5399-5403. www.pnas.org/content/98/10/5399.full.pdf.
[29] Erwin, D.H., 2001. Lessons from the past: Biotic recoveries from mass extinctions. Proceedings National Academy of Sciences, 98 (10), 5399-5403. www.pnas.org/content/98/10/5399.full.pdf.
[30] Ksepka, D.T., Stidham, T.A. y Williamson, T.E., 2017. Early Paleocene landbird supports rapid phylogenetic and morphological diversification of crown birds after the K–Pg mass extinction. Proceedings National Academy of Sciences, edición anticipada. www.pnas.org/content/early/2017/07/05/1700188114.
[31] Feng, Y.-J., Blackburn, D.C., Liang, D., Hillis, D.M., Wake, D.B.,1Cannatella, D.C. y Zhang, P., 2017. Phylogenomics reveals rapid, simultaneous diversification of three major clades of Gondwanan frogs at the Cretaceous–Paleogene boundary. Proceedings National Academy of Sciences, edición anticipada. www.pnas.org/content/early/2017/06/26/1704632114.full.pdf.
[32] MacFadden, B.J., 2005. Fossil horses – evidence for evolution. Science, 307, (5716), 1728-1730. http://science.sciencemag.org/content/307/5716/1728.full.
[33] Simmons, N.B., 2008. Taking wing. Scientific American, 299 (6), 66-73. www.scientificamerican.com.
[34] Berendse, F. y Scheffer, M., 2009. The angiosperm radiation revisited, an ecological explanation for Darwin’s ‘abominable mystery’. Ecology Letters, 12, 865–872. http://onlinelibrary.wiley.com/doi/10.1111/j.1461-0248.2009.01342.x/full.
[35] Wang, H., Moore, M.J., Soltis, P.S., Bell, C.D., Brockington, S.F., Alexandre, R., Davis, C.C., Latvis, M., Manchester, S.R. and Soltis, D.E., 2009. Rosid radiation and the rapid rise of angiosperm-dominated forests. Proceedings National Academy of Sciences, 106 (10), 3853-3858. www.pnas.org/content/106/10/3853.full.pdf.
[36] Gould, 1989. Ver nota 23.
[37] Minter, N.J., Buatois, L.A., Mángano, M.G., Davies, N.S., Gibling, M.R., MacNaughton, R.B. y Labandeira, C.C., 2017. Early bursts of diversification defined the faunal colonization of land. Nature Ecology & Evolution, 1, 0175. www.nature.com/articles/s41559-017-0175.
[38] Rokas, A., Krüger, D. y Carroll, S.B., 2005. Animal evolution and the molecular signature of radiations compressed in time. Science, 310, 1933-1938. http://science.sciencemag.org/content/310/5756/1933.
[39] Pincheira-Donoso, D., Harvey, L.P. y Ruta, M., 2015. What defines an adaptive radiation? Macroevolutionary diversification dynamics of an exceptionally species-rich continental lizard radiation. BMC Evolutionary Biology, 15, 153. https://bmcevolbiol.biomedcentral.com/articles/10.1186/s12862-015-0435-9.
[40] Schluter, D., 2000. The Ecology of Adaptive Radiation. Oxford University Press.
[41] Gavrilets, S. y Losos, J.B., 2009. Adaptive radiation: contrasting theory with data. Science, 323, 732-737. http://science.sciencemag.org/content/323/5915/732.
[42] Schluter, D., 2000. Ecological character displacement in adaptive radiation. The American Naturalist, 156 (Supplement), S4-S16. www.journals.uchicago.edu/doi/pdfplus/10.1086/303412.
[43] Gittenberger, E., 1991. What about non-adaptive radiation? Biological Journal of the Linnean Society, 43 (4), 263-272. http://onlinelibrary.wiley.com/doi/10.1111/j.1095-8312.1991.tb00598.x/full.
[44] Losos, J.B., 2010. Adaptive radiation, ecological opportunity, and evolutionary determinism. The American Naturalist, 175 (6), 623-639. www.journals.uchicago.edu/doi/10.1086/652433.
[45] Flohr, R.C.E., Blom, C.J., Rainey, R.B. y Beaumont, H.J.E., 2013. Founder niche constrains evolutionary adaptive radiation. Proceedings National Academy of Sciences, 110 (51), 20663-20668. www.pnas.org/cgi/doi/10.1073/pnas.1310310110.
[46] Ehrlich, P.R. y Raven, P.H., 1964. Butterflies and plants: A study in coevolution. Evolution, 18, 586-608. www.blackwellpublishing.com/ridley/classictexts/elrich1.pdf.
[47] Winkler, I.S., Mitter, C. y Scheffer, S.J., 2009. Repeated climate-linked host shifts have promoted diversification in a temperate clade of leaf-mining flies. Proceedings National Academy of Sciences, 106 (43), 18103-18108. www.pnas.org/content/106/43/18103.full.pdf.
[48] Agrawal, A.A., Fishbein, M., Halitschke, R., Hastings, A.P., Rabosky, D.L. y Rasmann, S., 2009. Evidence for adaptive radiation from a phylogenetic study of plant defenses. Proceedings National Academy of Sciences, 106 (43), 18067-18072. www.pnas.org/content/106/43/18067.full.pdf.
[49] Gould, S.J., 1989. Wonderful life. The Burgess Shale and the nature of history. W.W. Norton & Company.
[50] Foote, M., 1993. Discordance and concordance between morphological and taxonomic diversity. Paleobiology, 19 (2), 185-204. https://geosci.uchicago.edu/~foote/REPRINTS/PB1993_1.pdf.
[51] MacFadden, B.J., 2005. Fossil horses – evidence for evolution. Science, 307, 1728-1730. http://science.sciencemag.org/content/307/5716/1728.full.
[52] Begun, D.R., 2006. Planet of the apes. En: Becoming human. Evolution and the rise of intelligence. Scientific American, Special Edition, pág. 4-13. www.scientificamerican.com.
[53] Prentiss, W.C. and Chatters, J.C., 2003. Cultural diversification and decimation in the prehistoric record. Current Anthropology, 44 (1), 33-58. www.journals.uchicago.edu/doi/abs/10.1086/344488.

3 comentarios en “El ritmo de la evolución”