El gran auge del género humano lo debemos a nuestra capacidad de adaptarnos a nuestro entorno mediante nuestra organización y tecnología. Pero además, somos capaces de adaptar nuestro entorno a nuestras necesidades – lo que nos hace únicos entre los animales grandes que habitan la faz de la tierra. Esta capacidad es el resultado del desarrollo cultural de nuestra especie, del que hablamos en los últimos posts. Gracias a la evolución cultural hemos logrado dominar a nuestro entorno. Pero, ¿quiere esto decir que hemos dejado de lado la evolución biológica? ¿Han dejado nuestros cuerpos de adaptarse, mediante la selección natural, a los cambios en nuestro entorno? No: ¡todavía estamos evolucionando!
Hubo quien pensaba que, ahora que los humanos somos tantos y nuestra cultura está dominando la naturaleza, la evolución biológica habría quedado relegada a una posición secundaria, irrelevante[1]. Pero justamente gracias a nuestra población tan grande ocurren más mutaciones, y nuestra cultura influye sobre cuáles de estas mutaciones pueden propagarse y hacernos evolucionar físicamente. Inclusive, hay quien dice que la evolución humana es ahora más rápida que nunca[2] (aunque otros proponen explicaciones alternativas por esta supuesta aceleración[3]).
Evolución y selección natural
La evolución de nuestra especie, así como la de cualquier otra especie en la tierra, es un proceso de cambios más o menos graduales en la forma (el fenotipo) de los individuos, causados por cambios a nivel genético (el genotipo). Estos cambios genéticos, llamados mutaciones, son básicamente errores de copiado del genoma (ADN) cuando se forman las células sexuales, o sea, los óvulos y los espermatozoides, y pueden ocurrir de distintas maneras. Se estima que un bebé humano recién nacido tiene, en promedio, unas 70 mutaciones nuevas con respecto al material genético de sus padres[4]. Muchas de estas mutaciones son neutras: no afectan el funcionamiento de las células. Otras son dañinas, al afectar la producción de moléculas importantes para la célula; tales mutaciones tienden a desaparecer rápidamente de la población, ya que los individuos afectados por las mismas suelen tener pocos descendientes, o inclusive morir antes de alcanzar la edad de reproducción[5]. Pero también ocurren mutaciones beneficiosas, que mejoran la capacidad del organismo de sobrevivir y por ende, tener más descendientes. Estas mutaciones generan nuevas variantes de genes existentes, que a lo largo de las generaciones van a volverse más comunes en la población, al tener más descendientes los individuos con estas mutaciones.
Por ejemplo, pudiera aparecer en una población una nueva variante de un gen, que resulta en una estatura más alta. Si esta variante es favorecida sobre las variantes anteriores del gen, que no resultan en una estatura más alta, la nueva variante se volverá más común en la población y aumentará la altura promedio de los individuos. La nueva variante puede ser favorecida porque individuos más altos tienen más probabilidad de reproducirse, al tener más éxito en obtener alimentos, o al encontrar pareja más fácilmente (ver también mi entrega del 25 enero 2015, Evolución por selección natural).
Hay distintas maneras para que una mutación, una vez ocurrida, pueda extenderse en una población. La más conocida es el mecanismo de la selección natural: si una mutación resulta en una mejor adaptación (adecuación) de un individuo a su entorno, este individuo tendrá más descendientes que aquellos individuos que no cuentan con esta mutación. Así la mutación se vuelve más común en la población, y el rasgo codificado en la mutación empezará a dominar. En la presente entrega estaremos hablando principalmente de esta selección natural como causante de la evolución.
Pero también puede volverse más común una mutación en una población por pura casualidad. Esto se llama deriva genética y puede ocurrir especialmente en poblaciones pequeñas[6]. Una mutación no muy beneficiosa puede volverse común en una población de forma aleatoria si, por ejemplo, una hambruna resulta en la muerte de muchos individuos que, por pura coincidencia, no tienen dicha mutación.
Por ejemplo, en el caso del cerumen (cera de los oídos), una mutación ocurrió hace unas decenas de miles de años en Asia, causando la producción de un cerumen seco en lugar del cerumen húmedo que es normal en el resto del mundo. La mutación se volvió dominante en grandes partes de China, Corea y Japón[7]. El cerumen seco no es más efectivo que el húmedo (los dos tipos son igual de efectivos), así que el éxito inicial de la mutación puede estar debido a un proceso de deriva genética[8].
Coevolución
La evolución biológica humana, en muchos casos, va de la mano de la evolución cultural. Cambios en nuestro comportamiento pueden causar cambios biológicos[9]. Esto es lo que se llama coevolución; hemos hablado de esto en la entrega del 24 septiembre 2017 (Evolución cultural). Un buen ejemplo de coevolución es la tolerancia a la lactosa, que se desarrolló en varias sociedades humanas que tienen animales domesticados que producen leche: en estas hay una alta ocurrencia de una variante genética que permite a los adultos procesar la lactosa y, como consecuencia, consumir la leche y aprovechar de esta fuente de alimentación[10]. La tenencia de animales domésticos es un rasgo cultural, que permitió que la tolerancia a la lactosa (un rasgo biológico) pudiera volverse común. De la tolerancia a la lactosa se habló en más detalle en la entrega del 14 octubre 2017 (Cómo digerir la leche).
Un caso clásico de coevolución es el desarrollo de nuestro cerebro. Este pudo desarrollarse tanto, según una hipótesis del primatólogo británico Richard Wrangham, debido al fuego. Como consecuencia del uso del fuego para cocinar alimentos y así hacerlos más digerible (algo que puede haber empezado hace unos cientos de miles de años), se pudo reducir el tamaño del intestino de nuestros ancestros y dirigir más energía al cerebro, que así pudo convertirse en el órgano, potente pero un gran consumidor de energía, que es ahora[11].
Otro ejemplo de coevolución puede ser el de los indios Xavánte. Los miembros de esta tribu amazónica se distinguen de otras tribus en sus alrededores (de las que se separaron hace unos 1500 años) por sus cabezas grandes, caras alargadas y narices anchas. El entorno natural de todas las tribus en la región es el mismo, así que el entorno no puede explicar la diferencia; pero los Xavánte tienen una diferencia cultural importante: las mujeres se casan, y tienen hijos, preferencialmente con los varones de estatus más alto, de manera que pocos varones son responsables de la mayoría de la progenie en la tribu. Esta característica cultural puede explicar por qué en tan poco tiempo se desarrolló un rasgo físico tan marcado en la tribu[12].
A continuación veremos unos ejemplos más de evolución humana reciente y actual. Varios de estos son también casos de coevolución, ya que están relacionados, de una manera u otra, al acervo cultural humano.
Métodos
El estudio de la evolución reciente es posible gracias a los adelantos en la genética. El análisis del material genético de grandes grupos de personas permite detectar cuáles son las distintas variantes genéticas que se encuentran en las poblaciones humanas actuales, y en qué proporciones. Puesto que a nosotros nos interesa determinar si la evolución todavía actúa sobre nuestra especie, y de hacerlo, cómo la hace, queremos detectar los rastros de evolución (o, mejor dicho, selección natural) en el material genético humano. Si una variante es beneficiada por selección natural, deberíamos ser capaces de detectarlo.
Afortunadamente es posible reconocer las trazas de la selección natural, especialmente en el caso de variantes genéticos que conllevan una ventaja clara al portador (en este caso se habla de selección natural positiva). En primer lugar, estas variantes beneficiosas tienden a ser comunes en la población. Además, suelen ir acompañados por genes adyacentes específicos. El proceso que da origen a estos grupos de genes se denomina arrastre por ligamiento: las variantes genéticas beneficiosas son pasadas de generación a generación, pero no solas, sino acompañadas por genes adyacentes, formando así bloques grandes de material genético que se puede identificar fácilmente en una población (ver la figura)[13]. La común presencia de un bloque de este tipo en una población indica que ocurrió un barrido genético: una variante beneficiosa de un gen barrió las demás variantes del gen y se volvió dominante. Esto evidencia la acción de selección natural. Se ha detectado en el genoma humano evidencia de múltiples barridos genéticos[14].
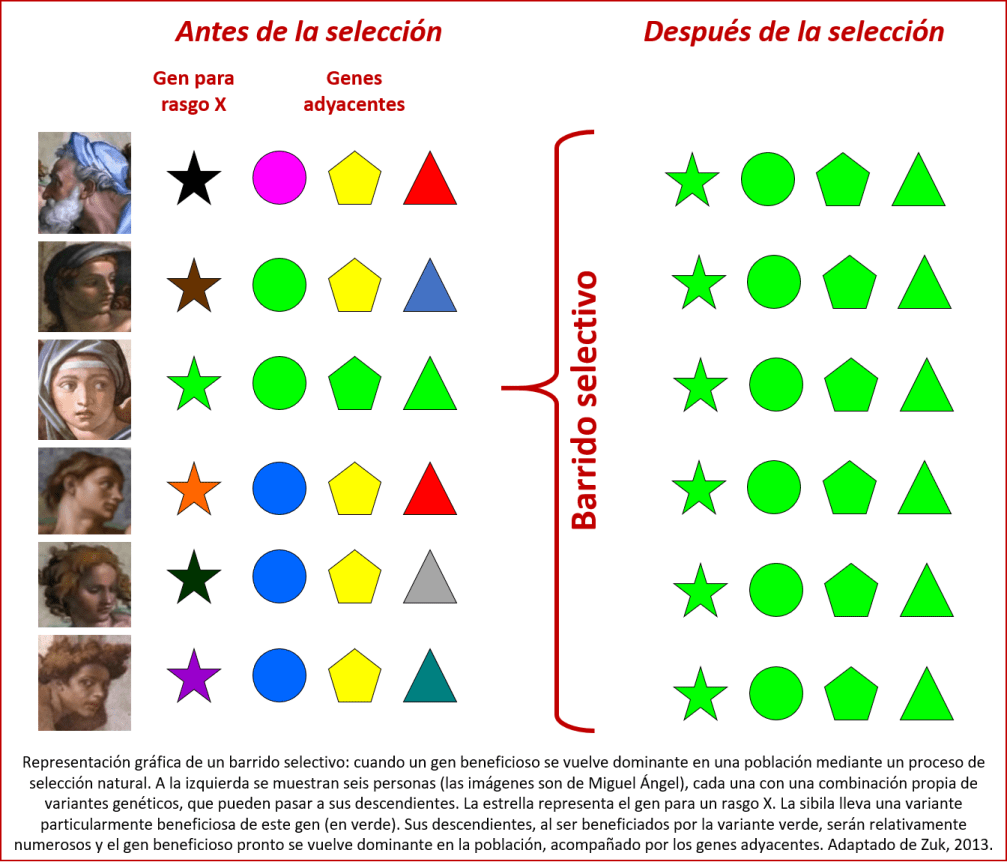
Aparte de detectar cuáles son las variantes genéticas presentes en una población, se puede determinar cuál es la edad de estas variantes. Se cuenta la cantidad de mutaciones inocuas (neutras), que no afectan al funcionamiento del gen, y se utiliza esto como un reloj: mientras más mutaciones inocuas hay en un gen y sus adyacencias inmediatas, más antiguo tiene que ser. Ya que se sabe aproximativamente cuántas mutaciones neutras ocurren en cada generación, se puede estimar cuándo apareció una mutación nueva. Si una variante ocurre comúnmente en una población, pero tiene pocas mutaciones neutras, debe ser una variante que apareció hace poco tiempo, pero que debe haber tenido un éxito tan grande que se propagó rápidamente por la población[15].
De esta manera, y algunas otras[16], se puede determinar no sólo cuáles son los cambios genéticos que nuestra especie está experimentando en los últimos tiempos, sino también cuán importantes son para nuestra supervivencia. Por ejemplo, en el caso de la tolerancia a la lactosa mencionada arriba, se determinó que en el Reino Unido la proporción de individuos tolerantes a la lactosa, o sea capaces de consumir la leche, aumentó dramáticamente: esta capacidad al parecer proporcionó una gran ventaja en términos de alimentación[17].
Selección natural reciente
Desde el momento que se empezó a leer el genoma (conjunto de genes) humano, se encontró evidencias de una fuerte y reciente selección positiva de ciertos genes[18]. O sea, ciertas mutaciones genéticas proporcionan al individuo un aumento tan grande en el potencial de tener descendientes, que su presencia en la población aumenta rápidamente a lo largo de pocas generaciones. Un buen ejemplo de una mutación beneficiosa que se propagó rápidamente, es la que ya vimos arriba: la que proporcionó tolerancia a la lactosa. Otros ejemplos son una variante genética que brinda resistencia a la malaria, que es común en grandes partes de África, donde la malaria es endémica[19]; y otra variante, que se volvió común en tan sólo 8000 años en Asia oriental, que regula la glucosa en la sangre y así ayuda a controlar la diabetes y la obesidad[20]. Asimismo, en poblaciones urbanas, que llevan mucho tiempo viviendo en ciudades, se desarrolló una resistencia a enfermedades típicas de la vida urbana, tales como la tuberculosis y la lepra[21].
Para saber cuáles rasgos físicos de la población humana actual (incluyendo los rasgos genéticos) están sujetos a selección natural, se ha estudiado la relación entre la presencia de estos rasgos en grandes grupos de personas y la cantidad de hijos de estas personas. Si un rasgo correlaciona de manera significativa con una mayor cantidad de hijos, se puede suponer que este rasgo es relevante desde el punto de vista de la selección natural. En un estudio de este tipo, realizado utilizando datos de miles de estadounidenses nacidos a mediados del siglo XX, se ha detectado por ejemplo que la edad de la menarquía (inicio de la menstruación) en las mujeres tiende a reducirse debido a selección natural. Pero se detectó también que la selección natural actúa más lentamente y ejerce menos impacto sobre la evolución humana que los factores culturales y ambientales, tales como la alimentación y la educación[22].
Otro estudio parecido, que tomó la longevidad como medida del éxito evolutivo, una medida tal vez menos apropiada, encontró que la selección natural favorece, para las mujeres, una mayor edad al primer parto, y para ambos sexos, una mayor edad del inicio de la pubertad (pero el estudio mencionado anteriormente concluyó, en el caso de las hembras, lo opuesto) [23].
En términos generales, parece que la duración del período de fertilidad de las mujeres está aumentando, al adelantarse la menarquía y el primer parto (que depende en parte de factores biológicos, aunque también de factores culturales), mientras que la menopausia tiende a retrasarse; los tres parámetros son hereditables[24]. Estos efectos son pequeños, pero parecen resultar en lo que cuenta en la selección natural: un aumento de la cantidad de hijos. Por ejemplo, un estudio de una población rural preindustrial en Canadá, enfocado hacia mujeres casadas entre 1799 y 1940, demostró que, de hecho, la edad al primer parto se adelantó de 26 a 22 años, mientras que la cantidad de hijos que alcanzaron la edad de 15 años aumentó de 3 a 4 por mujer; lo que muestra como la selección natural favorece rasgos hereditarios que resultan en un aumento de los descendientes[25].
Obviamente, la tendencia en poblaciones postindustriales es distinta: hacia una reducción de la cantidad de hijos por mujer. Los factores socioculturales están ocultando las tendencias naturales. Pero, a pesar de las bajas tasas de fertilidad (basadas en parte en la contracepción) y mortalidad actuales, es posible detectar una señal de la selección natural y sexual[26].
Estatura
Se ha detectado en individuos del Reino Unido, tanto varones como mujeres, un aumento de la presencia de rasgos genéticos que, conjuntamente, favorecen una estatura alta[27]. De hecho, mediciones indican que en muchas sociedades a nivel mundial la estatura promedio ha estado aumentando durante los últimos siglos, especialmente en el Occidente, aunque la tasa de aumento se ha reducido considerablemente en los últimos decenios[28] y es posible que, en países desarrollados de Norteamérica y Europa, se haya llegado a un punto en que la estatura promedio no aumenta más[29]. Inclusive hay indicios que en los Estados Unidos pudiera estar reduciéndose, levemente, la estatura entre mujeres[30].
Las variantes genéticas para una mayor estatura (la estatura no depende de un solo gen, sino de varios que conjuntamente influyen sobre la estatura[31]) sólo pueden aumentar su presencia en una población si conllevan ciertas ventajas reproductivas. En Holanda, donde la estatura promedio es la más alta del mundo, se comprobó que los individuos altos tienen un mayor número de descendientes, y los hijos de las mujeres altas tienen una tasa de mortalidad menor[32]. Una de las posibles causas de esto es que la altura, a parte de tener su causa genética, refleja una buena alimentación. También hay otros factores que influyen sobre el aumento de la estatura: las condiciones sanitarias, el estándar de vida, los ingresos, y otros factores socioeconómicos[33]. Además, se comprobó que los humanos tenemos la tendencia de formar pareja con personas que se parecen a nosotros, de manera que individuos altos a menudo se emparejan con otros individuos altos, lo que resultaría en una progenie predispuesta a ser alta también[34].
Genomas antiguos
Las evidencias de selección natural enumeradas arriba se basan principalmente en el estudio del material genético de poblaciones humanas actuales. Las señales de evolución obtenidas de esta manera son generalmente sutiles y a veces contradictorias. Para encontrar señales más fuertes, es preciso estudiar los genomas de nuestros antepasados y compararlos con los actuales. Esto es posible gracias a la capacidad que ahora tenemos de recuperar material genético de los restos fósiles (huesos, dientes) de individuos que vivieron hace miles de años.
Al comparar la información genética disponible para 83 individuos que vivieron en Europa durante los últimos 8000 años y la de unas 500 personas vivas, se encontró indicios claros de selección natural en varios genes. Muy fuerte era la señal de la tolerancia a la lactosa, de la que ya se habló arriba: el gen que proporciona esta tolerancia estaba ausente hasta hace 4300 años, pero cuando apareció se volvió común bastante rápidamente. Otra señal muy fuerte era aquella para una piel clara: antes de la llegada de los agricultores hace alrededor de 7800 años, los cazadores-recolectores del sur de Europa tenían la piel oscura (los del norte ya la tenían clara), pero vieron reducida la pigmentación de la piel cuando los agricultores les pasaron sus genes de piel clara[35]. Se confirmó que la piel clara era predominante en Europa hace 3000 años, pero la tolerancia a la lactosa aun no era común[36].
Las variantes genéticas que, conjuntamente, codifican una estatura alta, siempre estuvieron más generalizadas en el norte y centro de Europa, mientras que los Yamnaya, el pueblo de pastores que vino de las estepas del sur de Rusia hace 4800 años y que probablemente trajo su idioma indoeuropeo (ver mi post del 19 noviembre 2017), eran muy altos también e introdujeron sus genes en la población europea[37].
Todo esto sugiere que la selección natural estuvo actuando sobre nuestra especie durante los últimos milenios.
Rubias con ojos azules
Hace unos 10.000 años, nuestros ancestros todavía tenían ojos marrones y el pelo en tonalidades oscuras. Pero entre 6000 y 10.000 años antes del presente ocurrió un cambio genético que resultó en una reducción de la cantidad de melanina en el ojo, causando un cambio de color: de marrón a azul. Este cambio ocurrió al parecer en el norte de Europa, posiblemente en la actual Dinamarca[38]. La mutación era biológicamente neutra, o sea no le confirió al portador una ventaja en términos de sobrevivencia, pero obviamente alguna ventaja tuvo que tener, ya que actualmente una proporción importante de los europeos del norte tiene ojos azules y el pelo rubio. Se determinó que hubo una fuerte presión selectiva sobre este rasgo: aumentó preferencialmente la cantidad de individuos rubios con ojos azules[39]. ¿Cuál puede haber sido la causa?
Esta causa estriba probablemente en algo que Darwin llamó “selección sexual”. Se refiere a lo siguiente: ciertos individuos son más atractivos que otros y por lo tanto encuentran pareja más fácilmente. La selección sexual juega un papel importante en muchas especies de animales (ver mi entrega del 25 enero 2015, Evolución por selección natural), incluyendo a nosotros, los humanos. Se considera que, cuando aparecieron por primera vez individuos de ojos azules y el pelo rubio, había más mujeres que varones, puesto que estos últimos tenían mayor mortalidad al dedicarse a actividades peligrosas tales como la caza y, posiblemente, conflictos con otras tribus. Esto implicaba que los pocos varones disponibles podían seleccionar sus parejas según su gusto. Y este gusto, al parecer, favorecía a las rubias, lo que resultaba en descendientes mayormente rubios. De esta manera aumentó rápidamente la proporción de rubias (y rubios) de ojos azules en las poblaciones del norte de Europa[40].
Cabe destacar que el aumento en la población de la proporción de individuos de pelo rubio y ojos azules estuvo acompañado de un incremento de la incidencia de una piel clara, o sea, de una menor pigmentación de la piel. Esto no necesariamente estuvo relacionado con preferencias sexuales o culturales, sino más bien con la ventaja que tiene una piel clara, especialmente en las latitudes altas (como en el norte de Europa) donde la intensidad del sol es menor, a la hora de sintetizar vitamina D. La vitamina D es elaborada en la piel bajo la influencia de rayos ultravioletas (UV); una menor pigmentación (ayudada por alguna mutación que desactiva FLG, una proteína que actúa como filtro de los rayos UV en la piel[41]) facilita la absorción de los rayos UV[42]. Se determinó que la deficiencia de vitamina D era común en Europa, también en tiempos prehistóricos[43], lo que sugiere que hubo una fuerte presión selectiva para la piel clara, así como para una mayor incidencia de mutaciones en la proteína FLG.
Normalmente, ojos azules y una piel clara van de la mano. Sin embargo, la conexión no es absoluta: un individuo de la actual España pero con material genético indicativo de un origen del norte de Europa, que vivió hace 7000 años, tenía ojos azules pero una tez oscura[44].
Cabe la pregunta, ¿si la piel clara es tan ventajosa en altas latitudes, por qué no se desarrolló en otras partes del mundo también, por ejemplo en el norte de Asia? Es un asunto circunstancial: la mutación que causó la piel clara se dio en el norte de Europa, en una población que ya estaba separada de la asiática, mientras que en Asia no ocurrió tal mutación; de manera que la piel clara no apareció en Asia, sino sólo en Europa[45].
Adaptación al entorno
La selección natural se refiere, en términos generales, a la adaptación de una especie a su entorno. Nuestra especie no es una excepción: al tener que adaptarnos a entornos extremos, hemos desarrollado variantes genéticas para ayudarnos a sobrevivir en estos entornos. Arriba hablamos ya de una adaptación a la vida en altas latitudes: la pérdida de la pigmentación de la piel. He aquí algunos ejemplos más.
El Tíbet ha sido llamado “el techo del mundo”, debido a que el altiplano tibetano tiene una altura promedio de 4000m por encima del nivel del mar. Está siendo habitado por el hombre de forma permanente desde hace por lo menos 7400 años[46]. Los tibetanos han tenido que ajustar sus cuerpos para sobrevivir en esas alturas, donde la concentración de oxígeno en el aire es 40% menos que al nivel del mar, y la irradiación de rayos UV 30% más fuerte. Se ha detectado la presencia de nueve mutaciones genéticas, siete de las cuales se hallan únicamente en el Tíbet, relacionadas entre otras cosas a una mejora de la capacidad de la sangre de transportar oxígeno, y un fortalecimiento del sistema inmunológico[47]. Estas mutaciones deben haberse dado hace no más de unos miles de años (una de ellas, en el gen EGLN1, ocurrió hace alrededor de 8000 años[48]); aunque otra mutación, en el gen EPAS1, pudiera provenir de una población arcaica del hombre de Denisova[49] – ver mi post de 29 abril 2015. Las nueve variantes genéticas reflejan una fuerte presión selectiva, o sea, proporcionan una ventaja tan grande que la selección natural las favorece de manera importante[50].
En el desierto suele hacer calor durante el día y frío por la noche, y los desiertos de Australia no son una excepción a esta regla. Los aborígenes australianos se adaptaron bien a ese mundo de extremos: son capaces de funcionar bien tanto de día, cuando las temperaturas están por encima de los 40°C, como de noche, cuando las temperaturas se acercan a los 0°C. De noche son capaces de dormir profundamente mientras que la temperatura de sus extremidades baja hasta llegar a 12-15 °C [51]. Por otro lado, sus cuerpos están adaptados también al calor extremo: dos variantes genéticas les permiten estar activos a temperaturas altas que causarían sobrecalentamiento y afectarían de manera negativa a personas no adaptadas al calor. Estas variantes genéticas reducen la liberación en la sangre de la hormona tiroxina, que regula el metabolismo. En el caso de un aumento de la temperatura corporal debido a alguna infección, la concentración de tiroxina en la sangre aumenta para ayudar el cuerpo a combatir la infección; pero cuando la temperatura aumenta de manera prolongada, por ejemplo debido al calor en el desierto, el alto nivel de tiroxina es dañino para el cuerpo, especialmente el cerebro. Las dos mutaciones que muchos aborígenes tienen, reducen al mínimo el aumento de la concentración de tiroxina, de manera que éstos puedan resistir mejor al calor del desierto[52].
El arsénico es un elemento extremadamente tóxico. Desafortunadamente hay muchos lugares en el mundo, por ejemplo en la India, donde se encuentra en el agua subterránea en concentraciones mayores a lo que se considera apto para el consumo humano, de manera que está causando enfermedades endémicas en ciertas regiones[53]. Sin embargo, en la zona de Quebrada Camarones en el desierto de Atacama (Chile), donde la concentración de arsénico en el agua que bebe la población sobrepasa cien veces el límite permitido, una de las concentraciones más altas en las Américas, los pobladores no muestran enfermedades relacionadas al arsénico. Estudios indicaron que estas personas tienen una variante genética que permite metabolizar el arsénico, lo que les da la capacidad de consumir el agua con arsénico sin sufrir los efectos adversos que afectan a las personas sin estas variantes. Esto es otro ejemplo de selección natural y evolución reciente (los primeros pobladores llegaron en la zona de Camarones hace sólo 7000 años) [54].
La culpa la tiene la agricultura
Tal como ya se mencionó anteriormente, muchos cambios recientes en el cuerpo humano tienen una causa cultural. Una fuerza cultural importante, de la que aun no hemos hablado, ha sido la agricultura: esta cambió la vida de nuestros antepasados tanto que éstos experimentaron cambios fisiológicos relevantes que ocurrieron en pocos miles de años después de la introducción de la agricultura, que ocurrió en el Oriente Medio alrededor de 9000 años a.C. [55]. Del nacimiento de la agricultura, elemento clave de lo que se llama la Revolución Neolítica, volveremos a hablar en un post futuro.
Por ejemplo, los huesos de nuestros antepasados cazadores, de antes de la agricultura, tenían una densidad mayor a la que tenemos desde que se impusiera la agricultura como principal fuente de alimento. Esto se puede deber a un mayor sedentarismo[56]. Inicialmente, sin embargo, la agricultura exigió mayores esfuerzos a los humanos y resultó en una peor salud, causada también por una alimentación menos variada, lo que se refleja en esqueletos inicialmente más pequeños, y un dimorfismo sexual (diferencia en estatura entre varones y mujeres) más pequeño. Las mujeres desarrollaron brazos muy fuertes, probablemente debido a las labores de recolección de granos y el molido, que solían ser tareas predominantemente femeninas[57]. Es sólo después de varios miles de años que las estaturas y el dimorfismo volvieron a aumentar, como consecuencia de una mejor alimentación y salud[58].
A nivel genético también se ha detectado cambios relacionados a la Revolución Neolítica. Un gen llamado FADS1 ocurre en múltiples variantes, dos de las que nos interesan: una que promueve la formación, en el cuerpo, de los ácidos grasos omega-3 y omega-6; y otra, que hace lo opuesto, al impedir su formación. Antes de la Revolución Neolítica, la variante más común en Europa (especialmente Europa del Sur) era la que impide la formación de estos ácidos; lo que tiene sentido, porque los cazadores-recolectores de aquellos tiempos tenían dietas basadas en carne y/o pescado, que son ricos en omega-3 y omega-6, de manera que no hace falta que el cuerpo los sintetice. Pero después de la Revolución Neolítica, que en Europa ocurrió hace unos 8000 años, se volvió dominante la variante que promueve la formación de omega-3 y omega-6 (así como de otros lípidos); esto se había vuelto importante, ya que la dieta más bien vegetariana de los agricultores resultó en una ingesta insuficiente de estos ácidos[59].
Cambios cerebrales
Otros cambios recientes en el cuerpo humano implican el cerebro, cuyo fuerte desarrollo caracteriza a nuestra especie. Dos variantes genéticas, ambas involucradas en el crecimiento del cerebro, aparecieron hace poco tiempo: una en el gen MCPH1 (microcefalina) apareció hace 37.000 años (posiblemente proveniente de una población de Neandertales[60]), y otra, en el gen ASPM, hace 5800 años. Ambas se volvieron comunes en poco tiempo, lo que indica una fuerte presión evolutiva[61].
Cicatrices de la evolución humana
La evolución biológica es un proceso sin rumbo preestablecido, que puede tener efectos adversos colaterales. Al estar enfocado hacia el éxito reproductivo (cuanto más descendientes mejor), hay otros aspectos que la evolución no toma tanto en cuenta. En el caso de la evolución humana, la evolución biológica nos ayudó a lograr el gran éxito reproductivo: nuestra especie está dominando el planeta. Pero, estamos pagando un precio por esto, en el sentido que nuestros cuerpos tienen ciertas debilidades que nos pueden afectar de manera negativa, especialmente en la vejez, después de la fase de la procreación. En un famoso artículo del 1951, el antropólogo estadounidense Wilton Krogman (1903-1987) llamó a esto “las cicatrices de la evolución humana” [62].
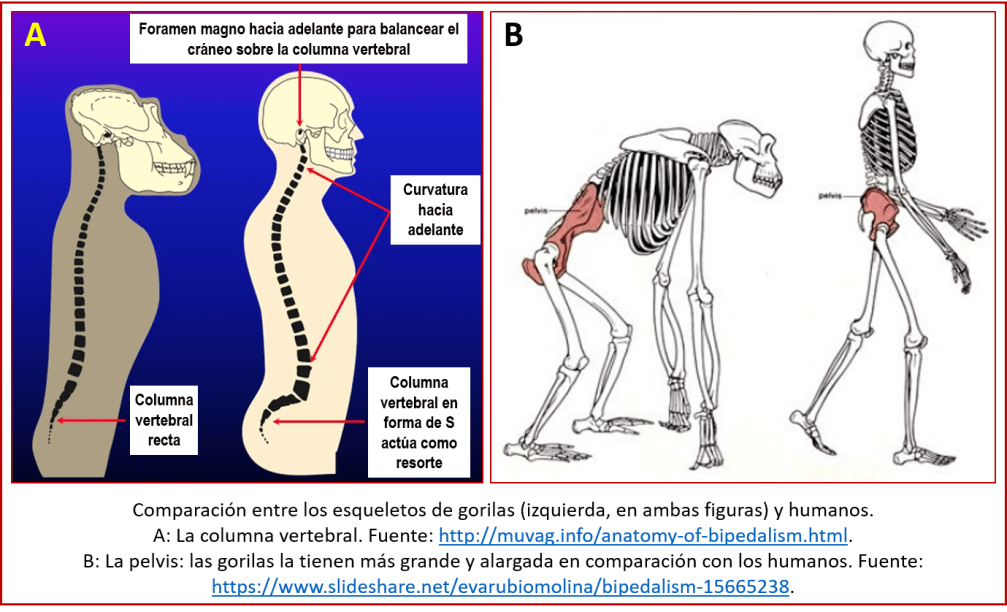
Por ejemplo, nuestra capacidad de caminar parados, sobre dos piernas (lo que se llama el bipedismo), ha supuesto grandes beneficios: entre otras cosas, liberó las manos de nuestros ancestros, lo que hizo posible el uso de herramientas. Pero la adaptación de nuestros cuerpos al bipedismo no es perfecta. Para empezar, nuestra espina dorsal, no diseñada para una postura vertical, sino una horizontal, se curvó para permitir un mejor balance del cuerpo (ver figura A); pero esto resultó en una susceptibilidad a enfermedades únicamente humanas, tales como las hernias discales, vértebras fracturadas, y la escoliosis. Nuestra pelvis se ha ido adaptando al bipedismo también; esto, conjuntamente con el aumento de tamaño de las cabezas de los fetos humanos, ha resultado en partos más difíciles y, en general, en un período de gestación tan corto que los bebés humanos nacen completamente indefensos (ver figura B). Y nuestros pies, que han tenido que convertirse de un apéndice móvil, diseñado para trepar árboles, a uno más bien rígido, apto para caminar, están sujetos a esfuerzos que pueden resultar en una variedad de lesiones del pie y el tobillo[63].
Asimismo, el desarrollo de nuestro cerebro (y de nuestra capacidad de hablar) han causado un cambio en la forma de la mandíbula, de manera que ya no hay suficiente espacio para los terceros molares: las muelas de juicio. A muchos estas muelas les salen mal, o no les salen, lo que puede causar fuertes dolores. (Por cierto, hay una mutación genética reciente que resulta en la completa ausencia de las muelas de juicio; esta se está haciendo más común, especialmente en regiones donde no hay servicios odontológicos[64].)
También hay ciertas enfermedades que se derivan de prácticas culturales. Debido a la higiene mejorada, nuestros sistemas inmunológicos están menos expuestos a parásitos y otros animales, lo que puede resultar en una hipersensibilidad y alergias, asma, y hasta enfermedades autoinmunes[65].
La obesidad, otra condición humana moderna con consecuencias negativas, ha sido relacionada con nuestro pasado evolucionario: si nuestros antepasados se beneficiaron de cuerpos que acumulan grasas, en previsión de tiempos de carestía, ahora, en tiempos de abundancia, esta propiedad ya no nos sirve – más bien, es dañina[66].
El sedentarismo actual no sólo resulta en mayor obesidad, sino también en una menor fuerza muscular: muchas de las marcas de atletas actuales palidecen en comparación con lo que eran capaces de hacer nuestros antepasados. En África, hace 100 años, jóvenes Tutsi eran capaces de saltar alturas de 2,52m, mientras que el récord mundial actual es de 2,45m. Asimismo, las huellas dejadas por unos aborígenes australianos de hace 20.000 años muestran que uno de ellos corrió a una velocidad de aproximadamente 37 km/h, sin calzado, sólo poco menos de los 42 km/h con las que Usain Bolt corrió sus mejores 100 metros[67].
Todo esto nos muestra que el cuerpo humano, por bien que generalmente nos sirva, está lejos de ser perfecto. La evolución nos ayuda entender la razón de esto[68].
Personalidad y selección
La selección natural parece actuar no sólo sobre rasgos fisiológicos, sino también sobre la personalidad de los individuos. Ciertos rasgos de la personalidad son hereditarios: por ejemplo la extroversión, una de las cinco dimensiones de la personalidad (ver mi post anterior), es hereditable en un 60%. Es justamente la extroversión que, por lo menos entre los varones de una población boliviana (no entre las mujeres), está relacionada a un mayor número de hijos[69]. Es posible que en esta población la selección natural favorezca a rasgos de la personalidad relacionados a una actitud sociable, tales como la extroversión y la apertura, y que por tanto, la proporción de individuos prosociales se mantiene alta.
Ser sociable es importante en todas las poblaciones humanas, ya que para poder funcionar en grupos es necesario que tengamos la actitud adecuada para comunicarnos y trabajar conjuntamente. Es probable que haya habido un proceso de selección natural para una actitud sociable y rasgos parecidos desde el momento que los humanos vivimos en grupos grandes.
Razas humanas
El concepto de razas humanas no tiene mucho sustento científico. Mejor sería hablar de poblaciones humanas con rasgos comunes, causados por ancestros comunes y mutaciones genéticas típicas de estas poblaciones[70]. En esta entrega se habló de unas cuantas mutaciones, muchas de las cuales son características de una población específica: por ejemplo la resistencia a la malaria, o el color de la piel y el pelo.
Los rasgos físicos que dieron origen a la diferenciación entre razas humanas son bastante recientes: surgieron en las últimas decenas de miles de años. Ya vimos que la piel blanca y el pelo claro se originaron hace pocos miles de años. El pelo negro, espeso y liso, típico de los habitantes del este de Asia, apareció hace 30.000 años debido a una mutación en el gen EDAR, que juega un papel importante en el desarrollo del pelo, la piel, las uñas y los dientes[71].
Conclusión
La evolución biológica de nuestra especie no ha terminado: existen claras evidencias de selección natural reciente en nuestro genoma. La tolerancia a la lactosa, la adaptación de los tibetanos a la altura, la capacidad de ciertos chilenos de metabolizar el arsénico, la protección de la malaria en África, una piel blanca en el norte de Europa, etc., se han producido durante los últimos miles de años y proporcionaron grandes ventajas, de manera que las variantes genéticas responsables de estas adaptaciones se propagaron rápidamente en las poblaciones donde estas adaptaciones resultaron beneficiosas. El aumento de la estatura es un cambio por lo menos en parte debido a selección natural, que en muchos países continúa en la actualidad.
La selección natural es, sin embargo, una fuerza subordinada: ahora juegan un papel más importante en la evolución humana factores socioculturales. Pero es evidente el papel clave de la coevolución: la interrelación entre factores culturales y genéticos. La aparición de la agricultura, un rasgo cultural, causó no sólo la tolerancia a la lactosa, sino también cambios físicos en las personas, y probablemente hasta cambios de personalidad. Y la selección sexual puede haber sido la causa de la ubicuidad, en varios países del norte de Europa, de personas blondas con ojos azules.
La selección natural también nos ha dejado algunos efectos adversos, tales como una columna vertebral que no está diseñada de manera óptima para nuestro bipedismo, o una mandíbula con insuficiente espacio para todos nuestros dientes como daño colateral de nuestro desarrollo cerebral.
¿Qué nos depara el futuro? Probablemente empezará a jugar un papel dominante otro tipo de selección: la selección humana. Ciertas clínicas de fertilización asistida inyectan citoplasma de óvulos de mujeres fértiles en los óvulos de las mujeres que reciben tratamiento para mejorar la probabilidad de éxito; de esta manera, el embrión resultante tiene material genético de un padre y dos madres[72]. Podremos asegurarnos de que los embriones de los futuros bebés no contengan variantes genéticas potencialmente dañinas, y no sólo eso, podremos cerciorarnos de que tengan codificados los rasgos físicos y cognitivos deseados[73]. Y, si acaso nace un bebé con alguna enfermedad o limitación física, se va a poder curar con terapias genéticas, o remediar con implantes biónicos. En tal caso, la selección natural habrá cedido el paso a la tecnología médica humana. Pero, mientras sigan ocurriendo mutaciones genéticas, la selección natural seguirá jugando un papel, así sea secundario[74].
Nota: la foto en el encabezado del post muestra un momento de la festividad religiosa Monlam, en el monasterio budista de Labrang (Tíbet). Fuente: http://savetibet.ru/2012/02/07/print:page,1,labrang.html.
[1] Ver por ejemplo: www.telegraph.co.uk/news/science/science-news/3352984/Evolution-is-complete-so-where-do-we-go-from-here.html.
[2] Hawks, J., Wang, E.T., Cochran, G.M., Harpending, H.C. y Moyzis, R.K., 2007. Recent acceleration of human adaptive evolution. Proceedings of the National Academy of Sciences, 104 (52), 20753–20758. www.pnas.org/content/104/52/20753.full.pdf.
[3] Pritchard, J.K., 2010. How we are evolving. Scientific American, octubre 2010, 41-47. www.scientificamerican.com.
[4] Sohail, M., Vakhrusheva, O.A., Sul, J.H., Pulit, S.L. y Francioli, L.C., 2017. Negative selection in humans and fruit flies involves synergistic epistasis. Science, 356 (6337), 539-542. http://science.sciencemag.org/content/356/6337/539.
[5] Ver: https://en.wikipedia.org/wiki/Negative_selection_(natural_selection).
[6] Ver: https://es.wikipedia.org/wiki/Deriva_gen%C3%A9tica.
[7] Yoshiura, K. y otros, 2006. A SNP in the ABCC11 gene is the determinant of human earwax type. Nature Genetics, 38, 324-330. www.nature.com/articles/ng1733. The Super Science High School Consortium, 2009. Japanese map of the earwax gene frequency: a nationwide collaborative study by Super Science High School Consortium. Journal of Human Genetics, 54, 499-503. www.nature.com/articles/jhg200962.pdf.
[8] Zuk, M., 2013. Paleofantasy. Norton, New York. Cap. 10.
[9] Fisher, S.E. y Ridley, M., 2013. Culture, genes, and the human revolution. Science, 340 (6135), 929-930. http://science.sciencemag.org/content/340/6135/929.
[10] Curry, A., 2013. The milk revolution. Nature, 500, 20-22. www.nature.com/news/archaeology-the-milk-revolution-1.13471.
[11] Wrangham, R., 2009. Catching Fire: How Cooking Made Us Human. Basic Books. Ver también: https://en.wikipedia.org/wiki/Catching_Fire:_How_Cooking_Made_Us_Human.
[12] Hünemeier, T. y otros, 2012. Cultural diversification promotes rapid phenotypic evolution in Xavánte Indians. Proceedings of the National Academy of Sciences, 109 (1), 73-77. www.pnas.org/content/109/1/73.full.pdf.
[13] Barton, N.H., 2000. Genetic hitchhiking. Philosophical Transactions of the Royal Society B, 355, 1553-1562. http://rstb.royalsocietypublishing.org/content/355/1403/1553. Voight, B.F., Kudaravalli, S., Wen, X. y Pritchard, J.K., 2006. A map of recent positive selection in the human genome. PLOS Biology, 4 (4), e154. http://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.0040072. Pritchard, 2010. Ver nota 2.
[14] Williamson, S.H., Hubisz, M.J., Clark, A.G., Payseur, B.A. Bustamante, C.D. y Nielsen, R., 2007. Localizing recent adaptive evolution in the human genome. PLoS Genetics, 3 (6), e90. http://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.0030090.
[15] Pennisi, E., 2016. Humans are still evolving – and we can watch it happen. Science News, 17 mayo 2016. www.sciencemag.org/news/2016/05/humans-are-still-evolving-and-we-can-watch-it-happen.
[16] Sabeti, P.C. y otros, 2006. Positive natural selection in the human lineage. Science, 312 (5780), 1614-1620. http://science.sciencemag.org/content/312/5780/1614.
[17] Field, Y. y otros, 2016. Detection of human adaptation during the past 2000 years. Science, 354 (6313), 760-764. http://science.sciencemag.org/content/354/6313/760.long.
[18] Bustamante, C.D. y otros, 2005. Natural selection on protein-coding genes in the human genome. Nature, 437, 1153-1157. www.nature.com/articles/nature04240.
[19] Sabeti y otros, 2006. Ver nota 9. Hawks, J., 2014. Still evolving (after all these years). Scientific American, septiembre 2014, 86-91. www.scientificamerican.com.
[20] Chang, C.L., Cai, J.J., Lo, C., Amigo, J., Park, J.-I. y Hsu, S.Y.T., 2011. Adaptive selection of an incretin gene in Eurasian populations. Genome Research, 21, 21-32. http://genome.cshlp.org/content/21/1/21.abstract.
[21] Barnes, I., Duda, A., Pybus, O.G. y Thomas, M.G., 2010. Ancient urbanization predicts genetic resistance to tuberculosis. Evolution, 65 (3), 842–848. http://onlinelibrary.wiley.com/doi/10.1111/j.1558-5646.2010.01132.x/epdf.
[22] Beauchamp, J.P., 2016. Genetic evidence for natural selection in humans in the contemporary United States. Proceedings of the National Academy of Sciences, 113 (28), 7774-7779. www.pnas.org/content/113/28/7774.full.pdf.
[23] Mostafavi, H., Berisa, T., Day, F.R., Perry, J.R.B., Przeworski, M. y Pickrell, J.K., 2017. Identifying genetic variants that affect viability in large cohorts. PLOS Biology, 15 (9), e2002458. http://journals.plos.org/plosbiology/article/file?id=10.1371/journal.pbio.2002458&type=printable.
[24] Byars, S.G., Ewbank, D., Govindaraju, D.R. y Stearns, S.C., 2010. Natural selection in a contemporary human population. Proceedings of the National Academy of Sciences, 107 (S1), 1787-1792. www.pnas.org/content/107/suppl_1/1787.full.pdf.
[25] Milot, E., Mayer, F.M., Nussey, D.H., Boisvert, M., Pelletier, F. y Réale, D., 2011. Evidence for evolution in response to natural selection in a contemporary human population. Proceedings of the National Academy of Sciences, 108 (41), 17040-17045. www.pnas.org/content/108/41/17040.
[26] Bolund, E., Hayward, A., Pettay, J.E. y Lummaa, V., 2015. Effects of the demographic transition on the genetic variances and covariances of human life-history traits. Evolution, 69 (3), 747-755. http://onlinelibrary.wiley.com/doi/10.1111/evo.12598/abstract. Courtiol, A., Pettay, J.E., Jokela, M., Rotkirch, A. y Lummaa, V., 2012 Natural and sexual selection in a monogamous historical human population. Proceedings of the National Academy of Sciences, 109 (21), 8044-8049. http://www.pnas.org/content/109/21/8044.
[27] Field y otros, 2016. Ver nota 8.
[28] Garcia, J. y Quintana-Domeque, C., 2007. The evolution of adult height in Europe: A brief note. Economics & Human Biology, 5 (2), 340-349. www.sciencedirect.com/science/article/pii/S1570677X07000226.
[29] Marck, A. y otros, 2017. Are we reaching the limits of Homo sapiens? Frontiers in Physiology, 8, 812. www.frontiersin.org/articles/10.3389/fphys.2017.00812/full.
[30] Byars y otros, 2010. Ver nota 13.
[31] Guo, M. y otros, 2017. Epigenetic profiling of growth plate chondrocytes sheds insight into regulatory genetic variation influencing height. eLife, 6, e29329. https://elifesciences.org/articles/29329.
[32] Stulp, G., Barrett, L., Tropf, F.C. y Mills, M., 2015. Does natural selection favour taller stature among the tallest people on earth? Proceedings of the Royal Society B, 282: 20150211. http://rspb.royalsocietypublishing.org/content/royprsb/282/1806/20150211.full.pdf.
[33] Hatton, T.J. y Bray, B.E., 2010. Long run trends in the heights of European men, 19th–20th centuries. Economics & Human Biology, 8 (3), 405-413. www.sciencedirect.com/science/article/pii/S1570677X10000225.
[34] Robinson, M. y otros, 2017. Genetic evidence of assortative mating in humans. Nature Human Behaviour, 1, 0016. www.nature.com/articles/s41562-016-0016.
[35] Mathieson, I. y otros, 2015. Eight thousand years of natural selection in Europe. Versión preliminar en BioRxiv: www.biorxiv.org/content/early/2015/10/10/016477.
[36] Allentoft, M.E. y otros, 2015. Population genomics of Bronze Age Eurasia. Nature, 522, 167-172. www.nature.com/articles/nature14507.
[37] Mathieson y otros, 2015. Ver nota 23.
[38] Eiberg, H., Troelsen, J., Nielsen, M., Mikkelsen, A., Mengel-From, J., Kjaer, K.W. y Hansen, L., 2008. Blue eye color in humans may be caused by a perfectly associated founder mutation in a regulatory element located within the HERC2 gene inhibiting OCA2 expression. Human Genetics, 123 (2), 177-187. https://link.springer.com/article/10.1007%2Fs00439-007-0460-x.
[39] Field y otros, 2016. Ver nota 8.
[40] Frost, P., 2006. European hair and eye color: a case of frequency-dependent sexual selection? Evolution and Human Behavior, 27 (2), 85-103. www.ehbonline.org/article/S1090-5138%2805%2900059-0/abstract.
[41] Thyssen, J.P., Bikle, D.D. y Elias, P.M., 2014. Evidence that loss-of-function filaggrin gene mutations evolved in northern europeans to favor intracutaneous vitamin D3 production. Evolutionary Biology, 41 (3), 388-396. https://link.springer.com/article/10.1007/s11692-014-9282-7.
[42] Wilde, S. y otros, 2014. Direct evidence for positive selection of skin, hair, and eye pigmentation in Europeans during the last 5,000 y. Proceedings of the National Academy of Sciences, 111 (13), 4832-4837. www.pnas.org.
[43] Brickley, M.B., D’Ortenzio, L., Kahlon, B., Schattmann, A., Ribot, I., Raguin, E. y Bertrand, B., 2017. Ancient vitamin D deficiency: long-term trends. Current Anthropology, 58 (3), 420-427. www.journals.uchicago.edu/doi/pdfplus/10.1086/691683.
[44] Olalde, I. y otros, 2014. Derived immune and ancestral pigmentation alleles in a 7,000-year-old Mesolithic European. Nature, 507, 225-228. www.nature.com/articles/nature12960.
[45] Pritchard, 2010. Ver nota 2.
[46] Meyer, M.C., Aldenderfer, M.S., Wang, Z., Hoffmann, D.L., Degering, D. Haas, W.R. y Schlütz, F., 2017. Permanent human occupation of the central Tibetan Plateau in the early Holocene. Science, 355 (6320), 64-67. http://science.sciencemag.org/content/355/6320/64.
[47] Yang, J. y otros, 2017. Genetic signatures of high-altitude adaptation in Tibetans. Proceedings of the National Academy of Sciences, 114 (16), 4189-4194. www.pnas.org/content/114/16/4189.full.pdf.
[48] Lorenzo, F.R. y otros, 2014. A genetic mechanism for Tibetan high-altitude adaptation. Nature Genetics, 46, 951-956. www.nature.com/articles/ng.3067.
[49] Huerta-Sánchez, E. y otros, 2013. Altitude adaptation in Tibetans caused by introgression of Denisovan-like DNA. Nature, 512, 194-197. www.nature.com/articles/nature13408.
[50] Yi, X. y otros, 2010. Sequencing of 50 human exomes reveals adaptation to high altitude. Science, 329 (5987), 75-78. http://science.sciencemag.org/content/329/5987/75. Beall, C.M., Song, K., Elston, R.C. y Goldstein, M.C., 2004. Higher offspring survival among Tibetan women with high oxygen saturation genotypes residing at 4,000 m. Proceedings of the National Academy of Sciences, 101 (39), 14300-14304. www.pnas.org/content/101/39/14300.full.pdf.
[51] Scholander, P.F., Hammel, H.T., Hart, J.S., LeMessurier, D.H. y Steen, J., 1958. Cold adaptation in Australian Aborigines. Journal of Applied Physiology, 13 (2), 211-218. www.physiology.org/doi/abs/10.1152/jappl.1958.13.2.211.
[52] Qi, X., Chan, W.L., Read, R.J., Zhou, A. y Carrel,l R.W.. 2014 Temperature-responsive release of thyroxine and its environmental adaptation in Australians. Proceedings of the Royal Society B, 281, 20132747. http://rspb.royalsocietypublishing.org/content/royprsb/281/1779/20132747.full.pdf.
[53] Daigle, K., 2016. Death in the water: Arsenic poisoning from wells is getting worse in India and other parts. Scientific American, enero 2016, 42-51. www.scientificamerican.com.
[54] Apata, M., Arriaza, B., Llop, E. y Moraga, M., 2017. Human adaptation to arsenic in Andean populations of the Atacama Desert. American Journal of Physical Anthropology, 163 (1), 192-199. http://onlinelibrary.wiley.com/doi/10.1002/ajpa.23193/abstract.
[55] Ver: https://en.wikipedia.org/wiki/Neolithic_Revolution.
[56] Chirchir, H., Kivell, T.L., Ruff, C.B., Hublin, J.-J., Zipfel, B. y Richmond, B.G., 2015. Recent origin of low trabecular bone density in modern humans. Proceedings of the National Academy of Sciences, 112 (2), 366-371. www.pnas.org/content/112/2/366.full.pdf.
[57] Macintosh, A., Pinhasi, R. y Stock, J.T., 2017. Prehistoric women’s manual labor exceeded that of athletes through the first 5500 years of farming in Central Europe. Science Advances, 3, eaao3893. http://advances.sciencemag.org/content/3/11/eaao3893/tab-pdf.
[58] Macintosh, A., Pinhasi, R. y Stock, J.T., 2016. Early life conditions and physiological stress following the transition to farming in Central/Southeast Europe: skeletal growth impairment and 6000 years of gradual recovery. PLoS ONE, 11 (2), e0148468. http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0148468&type=printable.
[59] Ye, K., Gao, F., Wang, D., Bar-Yosef, O. Y Keinan, A., 2017. Dietary adaptation of FADS genes in Europe varied across time and geography. Nature Ecology & Evolution, 1, 0167. www.nature.com/articles/s41559-017-0167.
[60] Evans, P.D., Mekel-Bobrov, N., Vallender, E.J., Hudson, R.R. y Lahn, B.T., 2006. Evidence that the adaptive allele of the brain size gene microcephalin introgressed into Homo sapiens from an archaic Homo lineage. Proceedings of the National Academy of Sciences, 103 (48), 18178-18183. http://www.pnas.org/content/103/48/18178.full.pdf.
[61] Evans, P.D. y otros, 2005. Microcephalin, a gene regulating brain size, continues to evolve adaptively in humans. Science, 309 (5741), 1717-1720. http://science.sciencemag.org/content/309/5741/1717. Mekel-Bobrov, N. y otros, 2005. Ongoing adaptive evolution of ASPM, a brain size determinant in Homo sapiens. Science, 309 (5741), 1720-1722. http://science.sciencemag.org/content/309/5741/1720.
[62] Krogman, W.M., 1951. The scars of human evolution. Scientific American, 185 (6), 54-57. www.nature.com/scientificamerican/journal/v185/n6/pdf/scientificamerican1251-54.pdf.
[63] Latimer, B., 2013. A Backache of longstanding: An evolutionary perspective on the human vertebral column. AAAS 2013 Annual Meeting, Boston. https://aaas.confex.com/aaas/2013/webprogram/Paper8679.html. Rosenber, K., 2013. Laboring humans. AAAS 2013 Annual Meeting. https://aaas.confex.com/aaas/2013/webprogram/Paper8524.html. DeSilva, J., 2013. Starting off on the wrong foot. AAAS 2013 Annual Meeting. https://aaas.confex.com/aaas/2013/webprogram/Paper8518.html.
[64] Mann, A., 2013. Wisdom can be painful: the evolutionary origins of third molar impaction in humans. AAAS 2013 Annual Meeting, Boston. https://aaas.confex.com/aaas/2013/webprogram/Paper8686.html.
[65] Nesse, R.M. y otros, 2010. Making evolutionary biology a basic science for medicine. Proceedings of the National Academy of Sciences, 107 (S1), 1800-1807. www.pnas.org/content/107/suppl_1/1800.
[66] Leonard, W., 2013. Metabolic challenges of the modern world: evolution and human nutritional health. AAAS 2013 Annual Meeting, Boston. https://aaas.confex.com/aaas/2013/webprogram/Paper8677.html.
[67] McAllister, P., 2009. Manthropology. Hachette Australia.
[68] Avise, J.C., 2010. Inside the human genome: A case for non-intelligent design. Oxford University Press.
[69] Gurven, M., von Rueden, C., Stieglitz, J., Kaplan, H. y Eid Rodriguez, D., 2014. The evolutionary fitness of personality traits in a small-scale subsistence society. Evolution & Human Behavior, 35 (1), 17-25. www.ehbonline.org/article/S1090-5138(13)00094-9/abstract.
[70] Ver por ejemplo: www.nytimes.com/2007/06/26/science/26human.html.
[71] Hawks, 2014. Ver nota 16.
[72] Ver: www.usnews.com/science/articles/2008/07/24/where-is-human-evolution-heading.
[73] Max, D.T., 2017. Beyond human. National Geographic, abril 2017, 40-63. https://www.nationalgeographic.com.
[74] Powell, R., 2011. The future of human evolution. The British Journal for the Philosophy of Science, 63 (1), 145-175. https://academic.oup.com/bjps/article-abstract/63/1/145/1591531.

Un comentario en “Evolución humana reciente”